
【题目】Q是合成某药品的中间体,其一种合成路线如下:
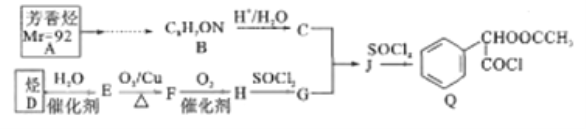
已知如下信息:
Ⅰ. 
Ⅱ. ![]()
回答下列问题:
(1)已知:在标准状况下,气体D的密度为1,25g/L,D能使溴的四氯化碳溶液褪色。D的名称是__;A的结构简式为_________
(2)C所含官能团名称是__;J![]() Q的反应类型是_______
Q的反应类型是_______
(3)Q的分子式为__________
(4)C和G反应生成J。写出化学方程式:__________
(5)M是J的同分异构体,M能发生水解反应且在核磁共报氢谱上有2组峰,峰的面积比为2:3,写出M所有可能的结构简式:___________
(6)设计由A为原料合成B的路线:____________
【答案】 乙烯 ![]() 羧基、羟基 取代反应 C10H9O3Cl
羧基、羟基 取代反应 C10H9O3Cl ![]()
![]()
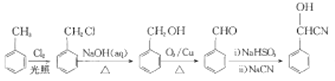
【解析】各物质结构简式如下:A、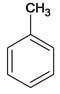 、B、
、B、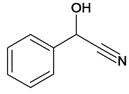 、C、
、C、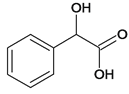 、D、
、D、![]() 、E、
、E、![]() 、F、
、F、![]() 、H、
、H、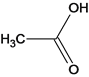 、G、
、G、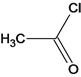 、J、
、J、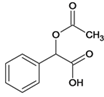 、Q、
、Q、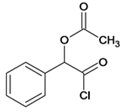 ,(1)在标准状况下,气体D的密度为1,25g/L,M(D)=1.25g/L×22.4L/mol=28g/mol,D能使溴的四氯化碳溶液褪色,含有不饱和键。D的名称是乙烯;芳香烃M为92,由商余法92÷12=7余8,化学式为C7H8,A的结构简式为
,(1)在标准状况下,气体D的密度为1,25g/L,M(D)=1.25g/L×22.4L/mol=28g/mol,D能使溴的四氯化碳溶液褪色,含有不饱和键。D的名称是乙烯;芳香烃M为92,由商余法92÷12=7余8,化学式为C7H8,A的结构简式为![]() ;(2)C
;(2)C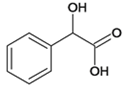 所含官能团名称是羧基、羟基;J
所含官能团名称是羧基、羟基;J![]() Q是J的羟基被氯取代,反应类型是取代反应;(3)Q
Q是J的羟基被氯取代,反应类型是取代反应;(3)Q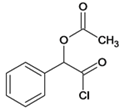 的分子式为C10H9O3Cl;(4)C和G反应生成J,发生取代反应,化学方程式:
的分子式为C10H9O3Cl;(4)C和G反应生成J,发生取代反应,化学方程式:![]() ;(5)M是J的同分异构体,M能发生水解反应且在核磁共报氢谱上有2组峰,说明M结构对称,含有酯基,峰的面积比为2:3,M所有可能的结构简式:
;(5)M是J的同分异构体,M能发生水解反应且在核磁共报氢谱上有2组峰,说明M结构对称,含有酯基,峰的面积比为2:3,M所有可能的结构简式:![]() ;(6)B中含有-CN,-OH,结合信息1,可由苯甲醛合成,甲苯与氯发生取代得
;(6)B中含有-CN,-OH,结合信息1,可由苯甲醛合成,甲苯与氯发生取代得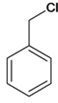 ,由A为原料合成B的路线:
,由A为原料合成B的路线: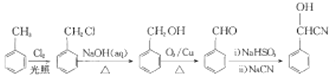 。
。


科目:高中化学 来源: 题型:
【题目】下列物质的俗名与化学式相对应的是( )
A.生石灰﹣Ca(OH)2
B.石膏﹣Na2SO410H2O
C.水玻璃﹣Na2SiO3水溶液
D.纯碱﹣NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质,下列实验现象和结论一致且正确的是
A. 加入有色布条,褪色,说明溶液中有Cl2存在
B. 溶液呈现黄绿色,且有刺激性气味,说明有Cl2存在
C. 先加入HCl溶液酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D. 新制氯水放置数天后酸性将减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制1mol/LNaOH溶液240mL,请回答:
(1)需称取NaOH固体_____g,用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小_______(填字母),并在下图中选出能正确表示游码位置的选项_________(填字母)。

(2)选用的主要玻璃仪器除烧杯、玻璃棒外还有_________________。
(3)下列操作的顺序是(用序号表示)_________________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需的NaOH的质量,加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)下列情况对所配制的NaOH溶液浓度有何影响?(用“偏大”“偏小”“无影响”填写)
①容量瓶用蒸馏洗涤后残留有少量的水________________。
②将热的溶液直接移入了容量瓶________________。
③定容时,仰视容量瓶的刻度线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:________________。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________。

(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是
A. CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ B. KCl+AgNO3=AgCl↓+KNO3
C. 4NH3+5O2![]() 4NO+6H2O D. CaCO3
4NO+6H2O D. CaCO3 ![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4粉末与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。据此判断下列说法中不正确的是( )
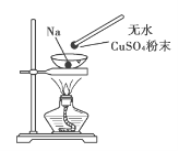
A. 上述反应是置换反应 B. 上述反应放出热量
C. 上述反应中CuSO4表现了还原性 D. 加热且无水条件下,Na可以与CuSO4反应并生成Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某学生用0.1500 mol/L NaOH溶液测定某未知浓度的盐酸溶液,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00 mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用序号字母填写):____→ → F → → → → D。
(2)操作F中应该选择图中滴定管_____(填标号)。

(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察_____。
(4)滴定结果如表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 0.60 | 20.60 |
3 | 25.00 | 0.20 | 20.19 |
计算该盐酸的物质的量浓度为_____(精确至0.0001)。
(5)下列操作会导致测定结果偏高的是_____。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
Ⅰ、写出用KMn04滴定H2C2O4的离子方程式_____________________。
Ⅱ、判断滴定终点的方法是________________________。
Ⅲ、计算:血液中含钙离子的浓度为_____mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com