
����Ŀ����1��ijѧ����0.1500 mol/L NaOH��Һ�ⶨijδ֪Ũ�ȵ�������Һ��������ɷֽ�Ϊ���¼�����
A��������ˮϴ���ζ���
B���ô��ⶨ����Һ��ϴ��ʽ�ζ���
C������ʽ�ζ���ȡϡ����25.00 mL��ע����ƿ�У������̪
D����ȡ��ƿ�����ظ�����2��3��
E�����ζ����Ƿ�©ˮ
F��ȡ�¼�ʽ�ζ����ñ�NaOH��Һ��ϴ����Һע���ʽ�ζ��ܡ�0���̶�����2��3 cm�����ٰѼ�ʽ�ζ��̶ܹ��ã�����Һ������0���̶Ȼ�0���̶�����
G������ƿ���ڵζ������棬ƿ�µ�һ�Ű�ֽ���ߵα�ҡ����ƿֱ���ζ��յ㣬���µζ���Һ�����ڿ̶�
���������գ�
��1���ζ�ʱ��ȷ������˳���ǣ��������ĸ��д����____�� �� F �� �� �� �� D��
��2������F��Ӧ��ѡ��ͼ�еζ���_____�����ţ���

��3���ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧע��۲�_____��
��4���ζ���������ʾ��
�ζ����� | ����Һ���/mL | ����Һ�����/mL | |
�ζ�ǰ�̶� | �ζ���̶� | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 0.60 | 20.60 |
3 | 25.00 | 0.20 | 20.19 |
�������������ʵ���Ũ��Ϊ_____����ȷ��0.0001����
��5�����в����ᵼ�²ⶨ���ƫ�ߵ���_____��
A����ʽ�ζ�����װҺǰδ�ñ�NaOH��Һ��ϴ
B���ζ������У���ƿҡ����̫���ң���ƿ����Һ�ν���
C����ʽ�ζ��ܼ��첿���ڵζ�ǰû�����ݣ��ζ��յ�ʱ��������
D���ﵽ�ζ��յ�ʱ�����Ӷ���
��6��������ԭ�ζ�ʵ��������к͵ζ����ƣ�����֪Ũ�ȵ���������Һ�ζ�δ֪Ũ�ȵĻ�ԭ����Һ��֮������Ѫ�Ƶĺ���ʱ����������ʵ�飺
�ٿɽ�2mLѪҺ������ˮϡ�ͺ������м�����������泥�NH4��2C2O4���壬��Ӧ���� CaC2O4��������������ϡ���ᴦ����H2C2O4��Һ��
�ڽ��ٵõ���H2C2O4��Һ����������KMnO4��Һ�ζ�����������ΪCO2����ԭ����ΪMn2+��
���յ�ʱ��ȥ20mL l.0��l0��4 mol/L��KMnO4��Һ��
��д����KMn04�ζ�H2C2O4�����ӷ���ʽ_____________________��
���жϵζ��յ�ķ�����________________________��
���㣺ѪҺ�к������ӵ�Ũ��Ϊ_____mol/L��
���𰸡� E��A��B��C��G �� ��ƿ����Һ��ɫ�ı仯 0.1200 mol/L A��D 2MnO4��+5H2C2O4+6H+=2Mn2++l0CO2��+8H2O ���������һ������KMnO4��Һ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ 2.5��10��3
�������������к͵ζ����ۺ����ã���1���ζ�ʵ������Ǽ���ζ����Ƿ�©Һ��ϴ�ӵζ��ܡ��ô�ʢҺ��ϴ�ζ��ܡ�װҺ����Һ�����¼����ƿ���������Һ���Ƕ�������ָʾ����Ȼ����еζ����ظ���������˱�ʵ����ȷ�IJ�����E��A��F��B��C��G��D����2��NaOHӦ��ʢװ�ڼ�ʽ�ζ����У�������ȷ����3���ζ�ʱ���۾�Ӧע��۲���ƿ����Һ��ɫ�ı仯����4�����εζ���Һ������ֱ���20.01��20.00��19.99������ƽ������NaOH�����Ϊ(20.01��20.00��19.99)/3mL=20.00mL��c(HCl)=20.00��10��3��0.1500/25.00��10��3mol��L��1=0.1200mol��L��1����5������c��=c���V��/V����A��δ�ñ�Һ��ϴ�ζ��ܣ����NaOH��ҺŨ�Ƚ��ͣ������ı�Һ�����������������Ũ��ƫ�ߣ���A��ȷ��B����ƿ��Һ�彦��������Һ���ʵ������٣����ı�Һ�������С�����������Һ�����ʵ���Ũ��ƫ�ͣ���B����C���ζ�ǰ���촦�����ݣ��ζ�����촦�����ݣ����ı�Һ��������٣����������ҺŨ��ƫ�ͣ���C����D���ζ��յ�ʱ�����Ӷ��������ı�Һ�����ƫ���������ҺŨ��ƫ�ߣ���D��ȷ����6��I.���ø�����ص�ǿ�����ԣ��Ѳ���������CO2����������ԭ��Mn2�������ӷ�Ӧ����ʽΪ��2MnO4��+5H2C2O4+6H��=2Mn2��+l0CO2��+8H2O��II.������ҺΪ��ɫ��Һ�����Ը��������Һ����ɫ���Ϻ�ɫ������жϵζ��յ�ķ����ǣ����������һ������KMnO4��Һ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ;III.������Ϣ��������ϵʽ��5Ca2����5H2C2O4��2MnO4����20��10��3��1��10��4��5=2��20��10��3��c(Ca2��) �����c(Ca2��)=2.5��10��3mol��L��1��


 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Q�Ǻϳ�ijҩƷ���м��壬��һ�ֺϳ�·������:
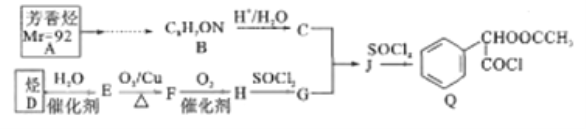
��֪������Ϣ:
��. 
��. ![]()
�ش���������:
��1����֪:�ڱ�״����,����D���ܶ�Ϊ1,25g/L,D��ʹ������Ȼ�̼��Һ��ɫ��D��������__;A�Ľṹ��ʽΪ_________
��2��C����������������__;J![]() Q�ķ�Ӧ������_______
Q�ķ�Ӧ������_______
��3��Q�ķ���ʽΪ__________
��4��C��G��Ӧ����J��д����ѧ����ʽ:__________
��5��M��J��ͬ���칹��,M�ܷ���ˮ�ⷴӦ���ں˴Ź�����������2��壬��������Ϊ2:3,д��M���п��ܵĽṹ��ʽ:___________
��6�������AΪԭ�Ϻϳ�B��·��:____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2+3H22NH3�Ѵﵽƽ�⡣����Ը�ƽ����ϵ��ѹ�������й�˵����ȷ����( )
A.NH3��Ũ������N2��H2Ũ�ȱ�ԭ��СB.NH3��Ũ������N2��H2��Ũ��Ҳ��ԭ����
C.����Ӧ���������淴Ӧ���ʼ�СD.�ñ仯��������������ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����Na2SO3��AgNO3�ڲ�ͬpH�µķ�Ӧ����̽������������:
��1������pH��ʵ���¼����:
ʵ�� | pH | ���� |
a | 10 | ������ɫ����,�Ժ��ܽ�,��Һ���� |
b | 6 | ������ɫ������һ��ʱ�����δ�ܽ� |
c | 2 | ����������ɫ������һ��ʱ���������״�غ�ɫ����X |
�������ϵ�֪:
I.Ag2SO3:��ɫ,������ˮ,���ڹ���Na2SO3����Һ
II.Ag2O:�غ�ɫ,������ˮ���ܺ��ᷴӦ
���Ʋ�a�а�ɫ����ΪAg2SO3,���ӷ���ʽ��____________________________��
���Ʋ�a�а�ɫ����ΪAg2SO4,�Ʋ��������_________________________________��
��2��ȡb��c�а�ɫ����������Na2SO3��Һ�У������ܽ⡣��ͬѧ���ʵ��ȷ���˰�ɫ��������Ag2SO4,ʵ�鷽����:��ȡAg2SO4��������_________��Һ��,δ�ܽ⡣
��3����X����Һ���˳���ϴ����Ϊȷ������ɣ�ʵ������:
I.��X�еμ�ϡ���ᣬ�����Ա仯
II.��X�м������ŨHNO3,��������ɫ����
III.��Ba(NO3)2��Һ��BaCl2��Һ����II�з�Ӧ�����Һ��ǰ���ޱ仯�����߲�����ɫ����
��ʵ��I��Ŀ����_________________________��
�ڸ�������������X�����ʺ�Ԫ�������__________________________��
��II�з�Ӧ�Ļ�ѧ����ʽ��________________________��
��4����ͬѧ�ۺ�����ʵ�飬��������X��ԭ��,��Ϊ�������Ե���ǿ��SO32-��ԭ����ǿ����ͨ����һ��ʵ��ȷ�������ֿ����ԣ�ʵ��װ����ͼ��ʾ:

������Y��__________________��
�ڰ�ɫ����ת��ΪX�Ļ�ѧ����ʽ��__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ķ�������ȷ���ǣ�������
A.����������
B.����������
C.����������
D.�������������COһ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л��������˵����ȷ���ǣ� ��
A. ����ʽΪC8H8O2�ķ����廯���������������ͬ���칹����3��
B. ��ѿ�ǵ�ˮ�����������,�һ�Ϊͬ���칹��
C. �������ı��ͱ���ϩ(![]() )��ȫȼ��,���������������ͬ
)��ȫȼ��,���������������ͬ
D. ����ʽΪC4H8Cl2�Һ������������л�����4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1���pH=2.5��������10���ijһԪǿ����Һǡ����ȫ��Ӧ����ü���Һ��pH���ڣ� ��
A. 9.0 B. 9.5 C. 10.5 D. 11.0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����������÷�Һ©��������ǣ�������
A.ֲ���ͺ�ˮ�Ļ����
B.����ɳ��ʳ��ˮ
C.�Ҵ���ˮ��Һ
D.���ᱵ���Ȼ����Ĺ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com