
【题目】某温度下,将2molA和3molB充入体积为2L的密闭容器中进行化学反应:A(g)+B(g)2C(g)△H<0,反应进行到10s时达到平衡,此时测得C的物质的量为2.4mol.回答下列问题:
(1)反应达平衡时B在平衡混合气体中的体积分数为;
(2)若反应温度升高,A的转化率;(填“增大”、“减小”或“不变”)
(3)该温度下该反应的平衡常数K=;
(4)平衡后,其他条件不变的情况下,将体积压缩到原来的 ![]() 时,对该反应产生的影响是;
时,对该反应产生的影响是;
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正、逆反应速率都不变,平衡不移动,各物质物质的量不变
C.正、逆反应速率都增大,平衡不移动,B的物质的量浓度为1.8mol/L
D.正、逆反应速率都增大,平衡不移动,各物质的物质的量不变
(5)可以证明恒温恒容条件下该可逆反应已达到平衡状态的是 .
A.混合气体的密度不随时间而改变
B.混合气体的平均摩尔质量不随时间而改变
C.B和C在混合气体中的体积分数之比不随时间而改变
D.体系的压强不随时间而改变
(6)若维持容器体积和温度不变,某时刻测得A、B、C的浓度分别为1mol/L、3mol/L、2mol/L,则此时该反应的正反应速率逆反应速率.(填“大于”、“小于”或“等于”)
【答案】
(1)36%
(2)减小
(3)4
(4)CD
(5)C
(6)大于
【解析】解:(1)某温度下, 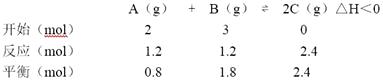
相同条件下气体的体积分数等于其物质的量分数= ![]() ×100%=
×100%= ![]() ×100%=36%,
×100%=36%,
所以答案是:36%;(2)该反应的正反应是放热反应,升高温度平衡向吸热方向即逆反应方向移动,A的转化率减小,
所以答案是:减小;(3)开始时c(A)= ![]() =1mol/L、c(B)=
=1mol/L、c(B)= ![]() =1.5mol/L,平衡时c(C)=
=1.5mol/L,平衡时c(C)= ![]() =1.2mol/L,
=1.2mol/L,
某温度下,
化学平衡常数K= ![]() =
= ![]() =4,
=4,
所以答案是:4;(4)平衡后,其他条件不变的情况下,将体积压缩到原来的 ![]() 时,压强增大平衡不移动,但各物质的浓度增大为原来的2倍,所以B物质浓度是1.8mol/L,但各物质的物质的量不变,故选CD;(5)A.无论反应是否达到平衡状态,混合气体的密度始终不变,所以不能据此判断平衡状态,故A错误;
时,压强增大平衡不移动,但各物质的浓度增大为原来的2倍,所以B物质浓度是1.8mol/L,但各物质的物质的量不变,故选CD;(5)A.无论反应是否达到平衡状态,混合气体的密度始终不变,所以不能据此判断平衡状态,故A错误;
B.反应前后气体的物质的量不变、气体的质量不变,所以混合气体的平均摩尔质量始终不变,不能据此判断平衡状态,故B错误;
C.B和C在混合气体中的体积分数之比不随时间而改变时,正逆反应速率相等,反应达到平衡状态,故C正确;
D.反应前后气体总物质的量不变,则体系的压强始终不变,不能据此判断平衡状态,故D错误;
故选C;(6)该反应的浓度商= ![]() =1.3<4,平衡正向移动,则正反应速率大于逆反应速率,
=1.3<4,平衡正向移动,则正反应速率大于逆反应速率,
所以答案是:大于.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的△H表示可燃物燃烧热的是( )
A.2H2(g)+O2(g)=2H2O(l)△H1
B.C(s)+ ![]() O2(g)=CO(g)△H2
O2(g)=CO(g)△H2
C.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O( l )△H3
D.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O( l )△H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要求设计实验证明:某种盐的水解是吸热的。有四位同学分别作出如下回答,其中不正确的是( )
A.甲同学:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B.乙同学:用加热的方法可以制备Fe(OH)3胶体,说明含Fe3+的盐水解是吸热的
C.丙同学:通过实验发现同浓度的热的纯碱溶液比冷的纯碱溶液去油污效果好,说明碳酸钠水解是吸热的
D.丁同学:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸发)后若红色加深,说明醋酸钠水解是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2mol NaHCO3 和一定量的Na2O2固体混合,在加热的条件下使其充分反应,经测定无Na2O2剩余,则最后所得固体的物质的量为( )
A.1 mol﹣2 mol之间
B.1mol﹣4mol之间
C.2 mol﹣4 mol之间
D.大于4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用时,反应条件改变, 不会引起产物种类
变化的是( )
A.Na和O2 B.Ca(OH)2和CO2
C.Fe和HCl D.C和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断 裂时吸收热量496kJ,氢气中1mol H﹣H键断裂时吸收热量为436kJ,求水蒸气中1mol H﹣O键形成时放出热量( )
A.463kJ
B.557kJ
C.486kJ
D.188kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌及其化合物的性质与铝及其化合物相似。如图,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度(假设Zn2+浓度为10-5 mol·L-1时,Zn2+已沉淀完全)。下列说法不正确的是( )
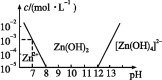
A.往ZnCl2溶液中加入足量氢氧化钠溶液,离子方程式为Zn2++4OH-![]() [Zn(OH)4]2-
[Zn(OH)4]2-
B.从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17
C.某废液中含Zn2+,沉淀Zn2+可以控制溶液pH的范围是8~12
D.向1 L 1 mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH 2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然油脂结构的核心为甘油[HOCH2CH(OH)CH2OH],有一瘦身用的非天然油脂,其结构的核心则为蔗糖(C12H22O11)。该非天然油脂可由直链型的不饱和油酸(C17H33COOH)与蔗糖反应而得,其反应示意图如下图所示(注意图中的反应式不完整)。
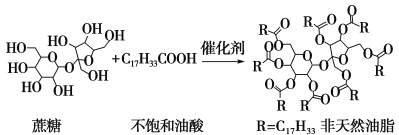
下列说法正确的是( )
A.蔗糖酯也是高级脂肪酸的甘油酯,属于油脂类物质
B.该非天然油脂与氢氧化钠溶液共热,其水解产物不与溴水反应
C.非天然油脂为高分子化合物
D.该蔗糖酯在稀硫酸的作用下水解,最终可生成三种有机化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com