
 3C(g)��2���Ӵﵽƽ�⣬����1.5 mol C����ʱ��ƽ��������C���������Ϊ��1�������¶����ߵ�70����������������䣬����Ӧ���´ﵽƽ��ʱ��C�����ʵ���Ϊ2.1 mol���������Ϊ��2����ش��������⣬
3C(g)��2���Ӵﵽƽ�⣬����1.5 mol C����ʱ��ƽ��������C���������Ϊ��1�������¶����ߵ�70����������������䣬����Ӧ���´ﵽƽ��ʱ��C�����ʵ���Ϊ2.1 mol���������Ϊ��2����ش��������⣬ 3C(g) ��Ӧ�Ѿ��ﵽƽ�����(����)
3C(g) ��Ӧ�Ѿ��ﵽƽ�����(����) 3C(g)
3C(g)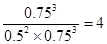
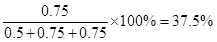 ��
��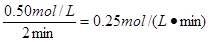


 ��ʱѵ���������������ϵ�д�
��ʱѵ���������������ϵ�д� �ƸԾ���Ȥζ����ϵ�д�
�ƸԾ���Ȥζ����ϵ�д� ����С����ҵ��ϵ�д�
����С����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 ?xC(g)����H<0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ��
?xC(g)����H<0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
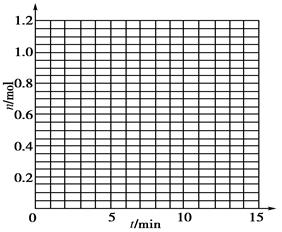
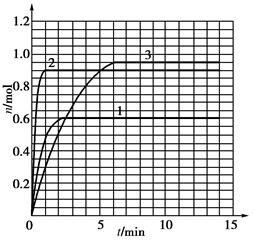
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 PCl3(g)��Cl2(g)
PCl3(g)��Cl2(g)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 2SO3��g������H����196.6kJ/mol����һ���¶��£���һ���ݻ�����������У�ͨ��3mol SO2��2mol O2�����������ʹ֮��Ӧ��ƽ��ʱ����������ѹǿΪ��ʼʱ��90������ʱ
2SO3��g������H����196.6kJ/mol����һ���¶��£���һ���ݻ�����������У�ͨ��3mol SO2��2mol O2�����������ʹ֮��Ӧ��ƽ��ʱ����������ѹǿΪ��ʼʱ��90������ʱ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����κ������£���ѧƽ�ⳣ������һ����ֵ |
| B�����ı䷴Ӧ���Ũ��ʱ����ѧƽ�ⳣ���ᷢ���ı� |
| C����ѧƽ�ⳣ��Kֻ���¶ȡ���Ӧ��Ũ�ȡ���ϵ��ѹǿ���й� |
| D����ѧƽ�ⳣ��K�����ƶ�һ�����淴Ӧ���еij̶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g) ��H= -90.8kJ��mol-1��
CH3OH(g) ��H= -90.8kJ��mol-1��| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1molCO .2molH2 | 1mol CH3OH | 2molCO��4molH2 |
| CH3OH��Ũ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | �ų�Q1 kJ | ����Q2 kJ | �ų�Q3 kJ |
| ƽ�ⳣ�� | K1 | K2 | K3 |
| ��Ӧ��ת���� | �� 1 | �� 2 | �� 3 |
 CH3OCH3��g��+CO2��g����ͼΪ��ɫ��Դ��ֱ�Ӷ�����ȼ�ϵ�ء�����ԭ��ʾ��ͼ��a�缫�ķ�ӦʽΪ
CH3OCH3��g��+CO2��g����ͼΪ��ɫ��Դ��ֱ�Ӷ�����ȼ�ϵ�ء�����ԭ��ʾ��ͼ��a�缫�ķ�ӦʽΪ �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Fe(s)+CO2(g)�� ?��H=a kJ/mol��a >0�������¶���K=0.263�������йظ÷�Ӧ��˵����ȷ����
Fe(s)+CO2(g)�� ?��H=a kJ/mol��a >0�������¶���K=0.263�������йظ÷�Ӧ��˵����ȷ����| A��������1 mol Fe�������յ�����С��a kJ |
| B���������¶ȣ�����Ӧ���ʼӿ죬�淴Ӧ���ʼ�������ѧƽ�������ƶ� |
| C����������ѹǿ����ʱ��仯��������жϸ÷�Ӧ�Ѵﵽ��ѧƽ��״̬ |
| D���ﵽ��ѧƽ��״̬ʱ����c(CO)="0.100" mol/L����c(CO2)="0.0263" mol/L |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com