
| A. | c(H+)=c(OH-)=1×10-6mol•L-1的溶液 | |
| B. | 等物质的量的强酸和强碱反应后所得到的混合溶液 | |
| C. | 将pH=5的盐酸稀释100倍所得到的溶液 | |
| D. | 非电解质溶于水得到的溶液 |
分析 A.中性溶液中c(H+)=c(OH-);
B.等物质的量的强酸和强碱反应后,酸或碱可能过量;
C.酸溶液无限稀释也显酸性;
D.非电解质溶于水可能显酸性.
解答 解:A.c(H+)=c(OH-)=1×10-6mol•L-1的溶液,c(H+)=c(OH-)可知溶液显中性,故A正确;
B.等物质的量的强酸和强碱反应后,酸或碱可能过量,如等物质的量的硫酸与NaOH,氢离子过量,溶液显酸性,故B错误;
C.酸溶液无限稀释也显酸性,则将pH=5的盐酸稀释100倍所得到的溶液显酸性,故C错误;
D.非电解质溶于水可能显酸性,如二氧化硫溶于水得到的溶液显酸性,而氨气溶于水得到的溶液显碱性,故D错误;
故选A.
点评 本题考查酸碱混合溶液的定性判断,为高频考点,把握溶液显中性的原因、酸碱混合的过量判断等为解答的关键,侧重分析与应用能力的考查,注意结合实例分析,题目难度不大.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 的烃X,根据分析,下列说法中不正确的是( )
的烃X,根据分析,下列说法中不正确的是( )| A. | X的分子式为C5H4 | |
| B. | 分子中氢原子的化学环境有2种 | |
| C. | 1 mol X在一定条件下可与2 mol氢气发生反应 | |
| D. | X不能使高锰酸钾酸性溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
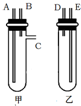 某兴趣小组要进行有关氢气的定量测定实验,为保证氢气不损失,设计用甲、乙两装置及橡胶管完成锌粒和稀硫酸制取氢气的操作.步骤如下:
某兴趣小组要进行有关氢气的定量测定实验,为保证氢气不损失,设计用甲、乙两装置及橡胶管完成锌粒和稀硫酸制取氢气的操作.步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从海水中提取溴的过程涉及氧化还原反应 | |
| B. | 海水含镁元素,将金属钠放入海水中可以制取金属镁 | |
| C. | 利用潮汐能发电是将化学能转化为电能 | |
| D. | 海底多金属结核矿是锰、硼、钛等的主要来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向苦卤(含K+、Mg2+、Br-等)中通入Cl2是为了提取溴 | |
| B. | 粗盐(含Ca2+、Mg2+、SO42-、泥沙等杂质)可采用除杂和重结晶等过程提纯 | |
| C. | 海带提碘只涉及物理变化,海水提镁涉及复分解反应 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com