
| A、乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 |
| B、分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 |
C、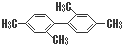 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 |
D、1mol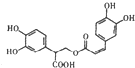 有机物 一定条件下能和7molNaOH反应 有机物 一定条件下能和7molNaOH反应 |
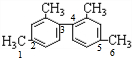 的甲基碳原子、甲基与苯环相连的碳原子、苯环与苯环相连的碳原子,处于一条直线,共有6个原子共线,所以至少有11个碳原子共面,故C正确;
的甲基碳原子、甲基与苯环相连的碳原子、苯环与苯环相连的碳原子,处于一条直线,共有6个原子共线,所以至少有11个碳原子共面,故C正确; 中含有酚羟基4mol,消耗氢氧化钠4mol,含有酯基1mol,能消耗氢氧化钠1mol,含有羧基1mol,能和1mol氢氧化钠反应,1mol
中含有酚羟基4mol,消耗氢氧化钠4mol,含有酯基1mol,能消耗氢氧化钠1mol,含有羧基1mol,能和1mol氢氧化钠反应,1mol 最多可与6molNaOH,故D错误,故选C.
最多可与6molNaOH,故D错误,故选C.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
 滴液漏斗已知:R-OH+HX→R-X+H2O
滴液漏斗已知:R-OH+HX→R-X+H2O| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g?cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=0.15 mol/(L?min) |
| B、v(B)=0.06 mol/(L?min) |
| C、v(C)=0.04 mol/(L?s) |
| D、v(D)=0.01 mol/(L?s)) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内压强不随时间的变化而变化 |
| B、容器内A、B、C、D四者共存 |
| C、C的生成速率是D的生成速率的两倍 |
| D、A的消耗速率是D的消耗速率的两倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可能为升温 |
| B、平衡一定不移动 |
| C、H2 转化率增大 |
| D、HI平衡浓度一定变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制的氯水在光照下颜色变浅 |
| B、合成NH3反应,为提高NH3的产率,理论上应采取相对较低温度的措施 |
| C、向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 |
| D、实验室中常用排饱和食盐水的方式收集氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 正极 | 负极 | 电解质溶液 | |
| A | Cu | Zn | CuSO4 |
| B | Cu | Zn | H2SO4 |
| C | Zn | Cu | CuCl2 |
| D | Mg | Zn | CuCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
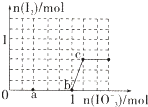 已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )
已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )| A、还原性:HSO3->I-,氧化性:IO3->I2>SO42- |
| B、a点处的氧化产物是SO42-,还原产物是I- |
| C、当溶液中的I-为0.4mol时,加入的KIO3一定为0.4mol |
| D、若向KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为:2IO3-+5HSO3-=I2,+5SO42-+3H++H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com