下列叙述正确的是( )
A.浓硫酸可干燥H2、SO2、NH3等气体
B.久置于空气中的氢氧化钠溶液,加足量盐酸时有气体产生
C.因海水中含有镁元素,故不需经过化学变化就可以得到镁单质
D.足量的硫单质与64g铜反应,有2mol电子发生转移
【答案】
分析:A.浓硫酸与氨气反应;
B.NaOH溶液与空气中的二氧化碳反应生成碳酸钠,能与盐酸发生反应;
C.海水中的镁元素存在于化合物中;
D.Cu与S反应生成Cu
2S.
解答:解:A.浓硫酸与氨气反应,则浓硫酸可干燥H
2、SO
2等气体,不能干燥NH
3,故A错误;
B.NaOH溶液与空气中的二氧化碳反应生成碳酸钠,碳酸钠能与盐酸发生反应生成二氧化碳气体,故B正确;
C.海水中的镁元素存在于化合物中,发生化学反应得到氯化镁,再利用电解方法冶炼Mg,故C错误;
D.Cu与S反应生成Cu
2S,64gCu反应转移的电子为
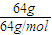
×(1-0)=1mol,故D错误;
故选B.
点评:本题考查浓硫酸的性质、金属冶炼、S的性质,为小综合,注重物质的性质的考查,选项D为学生解答的易错点,题目难度不大.

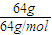 ×(1-0)=1mol,故D错误;
×(1-0)=1mol,故D错误;
