
科目:高中化学 来源: 题型:选择题
| A. | 石墨比金刚石稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1mol石墨比1mol金刚石的总能量高 | |
| D. | 1mol石墨与1mol金刚石完全燃烧放出的能量同样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
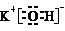 ;②O2的结构式O=O;③K2FeO4中Fe的化合价为+6;④上述反应的离子方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-.
;②O2的结构式O=O;③K2FeO4中Fe的化合价为+6;④上述反应的离子方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和聚乙烯都能使酸性KMnO4溶液褪色 | |
| B. | 等质量的乙烯与聚乙烯完全燃烧,产生的CO2质量相等 | |
| C. | 乙醇和乙醚(CH3CH2OCH2CH3)互为同分异构体 | |
| D. | 乙炔与苯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
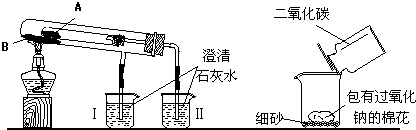
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{KOH}{→}$H-C≡
$\stackrel{KOH}{→}$H-C≡
 +H2O(-R、-R′、-R″表示肯呢个形态或可能不同的原子或原子团)
+H2O(-R、-R′、-R″表示肯呢个形态或可能不同的原子或原子团) ,反应类型是加成反应.
,反应类型是加成反应. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体通过盛有酸性高锰酸钾溶液的洗气瓶 | |
| B. | 气体通过盛有足量溴水的洗气瓶 | |
| C. | 气体通过盛有足量蒸馏水的洗气瓶 | |
| D. | 气体与适量HCl混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) | 溶解性 | ||
| 水 | 乙醇 | 乙醚 | ||||
| 1-苯乙醇 | 20 | 203.4 | 1.013 | 不溶 | 溶 | 溶 |
| 苯乙酮 | 19.7 | 202.3 | 1.028 | 不溶 | 溶 | 溶 |
| 硼氢化钠 | - | - | 1.076 | 溶 | 溶 | 不溶 |
| 乙醚 | -116.3 | 34.6 | 0.713 | 微溶 | 溶 | - |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com