
 .则计算:
.则计算: ,
,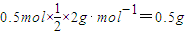 ,
,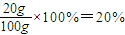 ;
;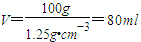 ,即0.08L,
,即0.08L,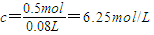


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2009—2010学年南宁二中高一下学期期末考试化学 题型:计算题
已知硅与强碱氢氧化钠溶液反应的化学方程式为:Si+2NaOH+H2O=Na2SiO3+2H2↑。现将11.5g钠和4.2g硅同时投入100g水中。
(1)钠与水反应的化学方程式为 ;
(2)在标况下共收集到H2 升;(提示:与Si反应的NaOH是过量的)
(3)若所得溶液的体积为100mL,则Na2SiO3溶液的物质的量浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .则计算:
.则计算:查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com