
【题目】仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置就能实现相应实验目的是( )
选项 | 实验目的 | 实验仪器或装置 |
A | 除去KCl中少的 MnO2 | 烧杯、玻璃棒、分液漏斗 |
B | 用10mol/L的盐酸配制100mL0.1mol/L的盐酸 | 100mL容量瓶、玻璃棒、烧杯 |
C | 用氯化钠溶液制备氯化钠晶体 |
|
D | 用右图装置验证SO2的漂白性 |
|
A. A B. B C. C D. D
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高.其主要流程如下.请回答下列问题: 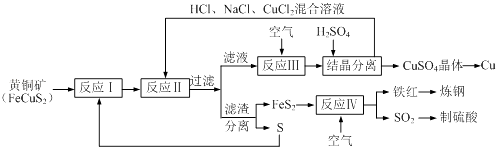
(1)反应Ⅲ的离子方程式为4CuCl2﹣+O2+4H+═4Cu2++8Cl﹣+2H2O,CuCl2﹣中铜元素的化合价为 , 该反应中的氧化剂是 .
(2)一定温度下,在反应Ⅲ所得的溶液中加入硫酸,可以析出硫酸铜晶体而不析出氯化铜晶体,其原因可能是 .
(3)炼钢时,可将铁红投入熔融的生铁中,以降低生铁的含碳量,该过程中主要反应的化学方程式是 .
(4)SO2尾气直接排放到大气中造成环境污染的后果是 .
(5)已知反应Ⅱ的离子方程式为Cu2++CuS+4Cl﹣═2CuCl2﹣+S,反应Ⅰ的产物为和 . (填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W代表短周期的四种元素,有关它们的部分信息如表所示:
元素 | 部分结构特点 | 部分性质 |
X | X的单质由双原子分子构成,分子中有14 | X有多种氧化物,如XO、XO2等 |
Y | Y原子的次外层电子数等于最外层电子数 | Y元素能形成多种单质 |
Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价的代数和等于6 |
W | 第三周期元素的简单离子中半径最小 | W的单质化学性质虽较活泼,但只需常温保存 |
请按要求回答下列问题(注意不能用字母X、Y、Z、W作答,请用相应的元素符号或化学式填写):
(1)X的元素名称是,X的气态氢化物的电子式是 .
(2)Z元素在周期表中的位置是第周期,第族.Z和W形成的化合物属于化合物(填“离子”或“共价”).
(3)X、Y、Z、W的原子半径从大到小的顺序是 .
(4)X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是: .
(5)铜和X的最高价氧化物的水化物的浓溶液反应的化学方程式: .
(6)气体分子(YX)2称为拟卤素,性质与卤素类似,请写出(YX)2与NaOH溶液反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 可用苯萃取四氯化碳中的碘
B. 苯滴入溴水中,发生取代反应生成溴苯
C. 可用石蕊试液区分乙醇和乙酸两种物质
D. 等物质的量的甲烷与氯气混合光照至充分反应,产物中最多是四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学学习了化学反应速率后,联想到曾用H2O2制备氧气,于是设计了下面的实验方案并进行实验探究.
实验编号 | 反应物 | 催化剂 |
甲 | 试管中加入3mL 2%H2O2溶液和3滴蒸馏水 | 无 |
乙 | 试管中加入3mL 5%H2O2溶液和3滴蒸馏水 | 无 |
丙 | 试管中加入3mL 5%H2O2溶液和3滴蒸馏水 | 1mL 0.1mol/L FeCl3溶液 |
丁 | 试管中加入3mL 5%H2O2溶液和3滴稀盐酸溶液 | 1mL 0.1mol/L FeCl3溶液 |
戊 | 试管中加入3mL 5%H2O2溶液和3滴NaOH溶液 | 1mL 0.1mol/L FeCl3溶液 |
【查阅资料】过氧化氢(H2O2),其水溶液俗称双氧水,常温下是一种无色液体,性质比较稳定.在加热的条件下,它能分解生成氧气.研究表明,将新制的5%的H2O2溶液加热到65℃时就有氧气放出,加热到80℃时就有较多氧气产生.
(1)上述实验发生反应的化学方程式为 .
(2)实验甲和实验乙的实验目的是;实验丙、实验丁和实验戊的实验目的是 .
(3)请根据该同学查阅的资料分析H2O2的性质,解释实验甲和实验乙能否达到实验目的?
(4)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在2分钟内6个时间点对注射器内气体进行读数,记录数据如表.
时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
气体体积/mL | 实验丙 | 9.5 | 19.5 | 29.0 | 36.5 | 46.0 | 54.5 |
实验丁 | 8.0 | 16.0 | 23.5 | 31.5 | 39.0 | 46.5 | |
实验戊 | 15.5 | 30.0 | 44.5 | 58.5 | 71.5 | 83.0 | |
①对实验戊,0~20s的反应速率v1=mL/s,100~120s的反应速率v2=mL/s.不考虑实验测量误差,二者速率存在差异的主要原因是 .
②如图是根据实验收集到最大体积的气体时所用时间绘制的图象.曲线c表示的是实验(填“丙”、“丁”或“戊”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温高压下,1L密闭容器中,发生如下反应:2H2+COCH3OH.反应开始时H2的物质的量为5mol,5min时变为0.5mol,则5min内该反应的平均反应速率v(H2)(单位:molL﹣1min﹣1)为( )
A.9.0
B.0.9
C.0.45
D.4.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 已知冰的熔化热为6.0kJ·mol-1,冰中氢键键能为20kJmol-1,假设每摩尔冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键
B. 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,Ka=(ca)2/c(1-a)。若加水稀释,,则CH3COOH![]() CH3COO-+H+向右移动,a增大,Ka不变
CH3COO-+H+向右移动,a增大,Ka不变
C. 甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
D. 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com