
| A. | Z的氢化物是同主族简单氢化物中最稳定的 | |
| B. | 非金属性:Z>Y>X | |
| C. | XY2中各原子最外层均满足8电子结构 | |
| D. | X、Y的最高价氧化物对应的水化物酸性后者强 |
分析 X、Y、Z为短周期元素.X的最外层电子数为内层电子数的2倍,则X为C元素;Y元素的最高正价与最低负价的代数和为4,则Y的最高价为+6价,负价为-2价,为短周期元素,所以Y为S元素;Z的原子半径小于S,而且位于第三周期,则Z为Cl元素.根据元素周期律的递变规律,再结合选项判断.
解答 解:A.Z为Cl元素,元素的非金属性越强,其氢化物的稳定性越强,所以氢化物的稳定性:HF>HCl>HBr>HI,即HF最稳定,故A错误;
B.X为C元素,Y为S元素,Z为Cl元素,非金属性:Z>Y>X,故B正确;
C.CS2的电子式类似于CO2,电子式为 ,CS2中各原子最外层均满足8电子结构,故C正确;
,CS2中各原子最外层均满足8电子结构,故C正确;
D.X为C元素,Y为S元素,碳酸为弱酸,硫酸为强酸,所以X、Y的最高价氧化物对应的水化物酸性后者强,故D正确.
故选A.
点评 本题考查位置结构性质的相互关系应用,题目难度不大,本题注意把握从化合价的角度推断元素的种类,学习中注重把握元素周期律.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
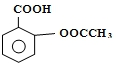 阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )
阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )| A. | 与乙酰水杨酸具有相同官能团的芳香族同分异构体共有8种(不考虑立体异构) | |
| B. | 乙酰水杨酸能发生取代、加成、氧化、还原反应 | |
| C. | 乙酰水杨酸的所有原子均在同一平面上 | |
| D. | 服用阿司匹林药量过大时,可出现精神错乱、惊厥甚至昏迷等水杨酸反应,可用硼酸溶液解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 现象或操作 | 解释或结论 |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去 | SO2具有漂白性 |
| B | 在0.1mol•L-1的CH3COONa溶液中,加2滴酚酞显浅红色,微热,溶液颜色加深 | 盐类水解反应是吸热反应 |
| C | 向少量火柴头的浸泡溶液中滴加AgNO3、HNO3和NaNO2混合溶液后,产生白色沉淀 | 火柴头里含有氯元素 |
| D | 蒸馏时,温度计的球泡应靠近蒸馏烧瓶支管口处 | 此位置指示的是馏出物的沸点 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释 |
| A | 向AlCl3溶液中逐滴加入NaOH溶液并振荡 | 产生白色沉淀,后沉淀逐渐溶解 | 铝元素具有一定的非金属性 |
| B | 将Fe(NO3)2固体溶于稀硫酸,滴加KSCN溶液 | 溶液变红 | 稀硫酸将Fe2+氧化为Fe3+ |
| C | 向KBrO3溶液中加入少量CCl4,然后通入少量Cl2,充分振荡,静置 | 下层呈橙色 | 氧化性:Cl2>Br2 |
| D | 将充有NO2的玻璃球放入热水中 | 红棕色加深 | 2NO2?N2O4△H>0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Li2CO3+Li2SiO3;该反应为放(填“吸”或者“放”)热反应,原因是升高温度,平衡向逆向进行,说明逆反应为吸热反应,所以正反应为放热反应.
Li2CO3+Li2SiO3;该反应为放(填“吸”或者“放”)热反应,原因是升高温度,平衡向逆向进行,说明逆反应为吸热反应,所以正反应为放热反应.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中3个碳原子在同一直线上 | |
| B. | 分子中所有原子都在同一平面上 | |
| C. | 分子中共价键的夹角为120° | |
| D. | 分子中共价键数为8,其中有一个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
下列属于电解质并能导电的物质是
A.淀粉 B.KNO3 溶液 C.FeC13 晶体 D.熔融的Na2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com