
【题目】NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.0.1 L 1 mol/L K2SO4 溶液中含有氧原子数为0.4NA
B.67.2L氯气所含的原子数是6NA
C.常温常压下,11.2 LO2含有电子数为8NA
D.在标准状况下,2.24LN2和O2的混合气体所含原子数为0.2NA
【答案】D
【解析】
A.0.1 L 1 mol/L K2SO4 溶液中,n=cv=0.1 L×1mol/L =0.1mol,则含有0.1mol SO42-,含有0.4mol氧原子,即0.4NA个氧原子,除此外,溶液中还有水,水中也含有氧原子,故A错误;
B. 67.2L氯气所含的原子数是6NA,没有告诉是否处于标况,无法计算物质的量,故无法计算粒子的数目,故B错误;
C. 常温常压下,不是在标况下,11.2 LO2不是0.5mol,一个氧分子含有16个电子,含有电子数不是8NA,故C错误;
D. 在标准状况下,22.4L任何气体所含的粒子的数目为1mol,即NA个,2.24LN2和O2的混合气体含有的分子数为=![]() =
=![]() =0.1mol,即0.1NA个电子,氮气的氧气都是双原子分子,故原子数为0.2NA,故D正确;
=0.1mol,即0.1NA个电子,氮气的氧气都是双原子分子,故原子数为0.2NA,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】I.配平__KMnO4 +__HCl=__KCl +__MnCl2 +__Cl2 ↑+__H2O反应方程式,若有1mol氧化剂参加反应,则被氧化的HCl的物质的量___,转移的电子数目___。
II.推理在问题解决过程中常涉及到。同学们要学会从实验数据、物质已知的性质、题给信息等各种渠道收集证据,对物质的性质及其变化提出可能的假设;基于这些证据进行分析推理,最后形成科学结论。
有无色溶液,可能含有K+、SO42-、CO32-、NH4+、Cl-、Ba2+、Cu2+中的一种或几种,按以下步骤进行实验:
①取100ml溶液往其中加入足量稀硫酸,有0.224L(标况下)气体产生;
②另取100ml溶液滴加足量Ba(NO3)2溶液,有4.2g白色沉淀生成;
③继续向②中的溶液滴加足量NaOH溶液并加热,产生刺激性气味的气体0.672L(标况下);根据以上事实判断:
(1)肯定存在的是___。
(2)肯定不存在的是___。
(3)不能确定是否存在的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请写出以下溶液的酸碱性(选填“酸性、碱性、中性”)
(1)NaCl溶液______________;
(2)(NH4)2SO4溶液 ___________;
(3)Na2CO3溶液 ___________;
(4)FeCl3溶液 _____________;
(5)CH3COONa溶液 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH固体配制500mL1.0mol/L的NaOH溶液,操作步骤如下:
①把称好的NaOH固体放入小烧杯中,加适量蒸馏水溶解,冷却至室温;
②把①所得溶液小心转入容量瓶中;
③继续向容量瓶中加蒸馏水至液面距刻度线1cm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶;
⑤将容量瓶瓶塞塞紧,充分摇匀;
⑥计算、称量NaOH固体的质量。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)⑥→①→②→___→___→⑤;
(2)所需仪器除托盘天平、药匙、烧杯、玻璃棒、胶头滴管外,还需用到的仪器有___;实验所需称量的NaOH固体为___g。
(3)试分析下列操作对所配溶液的浓度有何影响。(填“偏高”“偏低”或“无影响”)
①为加速固体溶解,可稍微加热并不断搅拌,在未降至室温时,立即将溶液转移至容量瓶定容。对所配溶液浓度的影响:___;
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响:___;
③定容时俯视液面。对所配溶液浓度的影响:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组学习电化学后,设计了下面的实验装置图,则下列有关该装置图的说法中正确的是 ( )
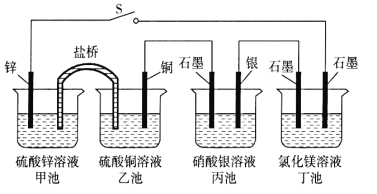
A. 合上电键后,盐桥中的阳离子向甲池移动
B. 合上电键后,丙池为电镀银的电镀池
C. 合上电键后一段时间,丙池中溶液的pH增大
D. 当丁池中生成标准状况下1120 mL Cl2气体时,丁池中理论上最多产生2.9 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 、
、![]() 为不同的核素,化学性质也不同
为不同的核素,化学性质也不同
B. 乙醇和乙醚互为同分异构体
C. CH3CH(CH3)2的名称叫2-甲基丙烷,也可以叫做异丁烷
D. CH2=CH2和CH2=CH-CH=CH2具有相同的官能团,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各小题。
(1)等浓度的三种溶液①NH4HCO3、② NH4Cl、③NH4HSO4,则c(NH4+)由大到小排列的顺序为____(填序号)。
(2)常温下,将0.1 mol·L-1的HCN溶液和0.1 mol·L-1的NaCN溶液等体积混合,测得混合液中c(HCN)>c(CN-),(假设混合过程中溶液体积的改变忽略不计)。则该混合液pH____7,c(HCN)+c(CN-)_____0.1 mol·L-1,c(HCN)-c(CN-)_____2c(OH-)(填“>”,“<”或“=”)。
(3)小苏打溶液显碱性而不是显酸性的原因:________,溶液中离子浓度大小顺序:___________。
(4)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。
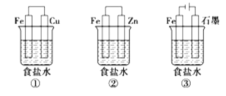
为防止金属Fe被腐蚀,可以采用上述________装置(填装置序号)原理进行防护;装置③中总反应的离子方程式为____________________。检验石墨电极产物气体的方法:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、CO2的吸收利用,对促进低碳社会的构建和环境的保护具有重要意义。
(1)已知C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H=a kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=b kJ·mol-1
H2O(l)=H2O(g) △H=c kJ·mol-1
则C2H4(g)+6NO(g)![]() 3N2(g)+2CO2(g)+2H2O(l)的反应热△H=______。
3N2(g)+2CO2(g)+2H2O(l)的反应热△H=______。
(2)用NH3催化还原NOx可以消除氮氧化物的污染。如下图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(脱氮率即氮氧化物的转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)![]() 2N2(g)+3H2O(g) △H<0。
2N2(g)+3H2O(g) △H<0。

以下说法正确的是______。
A.催化剂①、②分别适合于250℃和450℃左右脱氮
B.使用第②种催化剂更有利于提高NOx的平衡转化率
C.相同条件下,改变压强对脱氮率没有影响
D.在交叉点A处,不管使用哪种催化剂,上述反应都未达平衡。
(3)工业合成尿素的反应如下:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l) △H<0,在恒定温度下,将NH3和CO2按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示。
CO(NH2)2(l)+H2O(l) △H<0,在恒定温度下,将NH3和CO2按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示。
①若保持平衡时的温度和压强不变,再向容器中充入3mol的CO2,则此时v(正)______v(逆)(填>、<或=)。判断的理由是______。
②若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的NH3和1 mol CO2,在40min时重新达到平衡,请在图中画出25~50min内NH3的浓度变化曲线。______。

(4)用铝制作的“快速放电铝离子二次电池”的原理如右上图所示(EMI+为有机阳离子、电池工作时离子液体中微粒种类不变)。该电池放电时的负极反应方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙两个化学小组利用两套相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素(仅一个条件改变)。甲小组有如下实验设计方案。
实验编号 | 温度 | 催化剂 | 浓度 |
甲组实验Ⅰ | 25℃ | 三氧化二铁 | 10mL 5%H2O2 |
甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
甲、乙两小组得出如图数据:
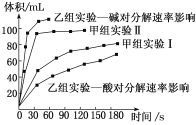
关于该实验下列叙述不正确的是
A. 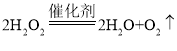 中,O2是氧化产物
中,O2是氧化产物
B. 甲小组实验得出的结论是Fe2O3比MnO2催化效率更高
C. 甲小组实验也可以测定25℃时,在相同时间内产生氧气的体积
D. 乙组研究的影响因素的数据分析,相同条件下H2O2在碱性环境下放出气体速率较快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com