
【题目】如图所示,x、y分别是直流电源的两极,通电后发现a极极板质量增加,b极极板处有无色无味的气体放出,符合这一情况的是( )

选项 | a极板 | b极板 | x电极 | z溶液 |
A | 锌 | 石墨 | 负极 | 硫酸铜 |
B | 石墨 | 石墨 | 负极 | 氢氧化钠 |
C | 银 | 铁 | 正极 | 硝酸银 |
D | 铜 | 石墨 | 负极 | 氯化铜 |
A. A B. B C. C D. D
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】①~⑦在元素周期表的对应位置如图所示,回答下列问题。
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑦ | ① | ② | |||||
3 | ③ | ④ | ⑤ | ⑥ |
(1)元素⑥的原子结构示意图___________;元素的最高正价①___________②(填>、<、=)
(2)向元素⑤和⑥形成的化合物的水溶液中加入过量的①的氢化物的水溶液,反应的离子方程式是______________
(3)元素③的最高价氧化物对应的水化物为_______(填离子化合物或共价化合物)
(4)元素②和③形成的一种化合物为淡黄色固体,该化合物的电子式为______,该化合物中化键有_______(填离子键、极性键或非极性键),该化合物与⑦的最高价氧化物反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今人类社会面临的严峻课题。回答下列问题:
(1)我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是________。
A.煤是重要的化工原料,把煤作燃料简单燃烧掉太可惜,应该综合利用
B.煤是发热很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料实惠
C.煤燃烧时产生大量二氧化硫和烟尘,对环境污染严重
D.通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
(2)乌克兰科学家将铜和铁混合熔化制成多孔金属,用于制作太空火箭上使用的煤油燃料雾化器,该雾化器的作用是_________________________________________________。
(3)乙醇是未来内燃机的首选环保型液体燃料。2.0 g乙醇完全燃烧生成液态水放出59.43 kJ的热量,表示乙醇燃烧热的化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类或归纳的说法中,正确的数目有( )
①化学反应中一定有物质变化但不一定有能量变化
②CaO+H2O=Ca(OH)2是放热反应,说明CaO的能量高于Ca(OH)2的能量
③分解反应都是吸热反应
④H2→2H的过程需要吸收能量
⑤H、D、T互称为同素异形体
⑥ 和
和 互为同分异构体
互为同分异构体
⑦ ![]() 和
和![]() 是同一种物质
是同一种物质
⑧MgCl2的形成过程是![]()
⑨分子式为C4H10的烃的一氯代物的同分异构体有4种
⑩PCl5分子中,所有原子都满足最外层为8电子结构
A. 3个B. 4个C. 5个D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验基本操作中正确的是( )
A.从碘水中提取I2时,向碘水溶液加入酒精进行萃取分液
B.蒸发结晶时,蒸发皿应放在石棉网上加热
C.用10 mL量筒量取7.50 mL浓盐酸
D.蒸馏时,冷凝水从冷凝管下管口进,由上管口出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图所示实验装置(部分加持装置已略去)制备无水CuCl2,并对实验过程中污染性气体进行处理。已知CuCl2易潮解。请回答以下问题:
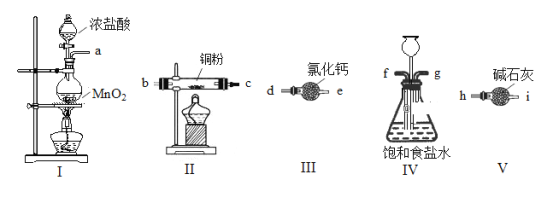
(1)用上图五个装置制取CuCl2,其连接顺序为______________(按气流方向,用小写字母表示)。
(2)装置I中发生反应的离子方程式为_____________________________________。
(3)装置III干燥管中氯化钙的作用是______________________________。
(4)实验开始时,先点燃装置________(填“I”或“II”)处的酒精灯。
(5)本实验中,用如图装置VI代替装置V是否可行______________(填 写“可行”或“不可行”)

(6)实验结束后,先关闭装置I处分液漏斗活塞, 再关闭装置IV的g处(用止水夹夹住),此时装置IV中长颈漏斗的作用是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿(FeCr2O4)中含有Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程示意图如下(部分操作和条件略):
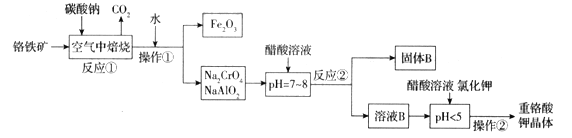
(1)铬铁矿(FeCr2O4)改写为氧化物的形式为___________________。
(2)反应①中发生了两个主要反应,其中一个主要反应的化学方程式为4FeCr2O4+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ______________________________。
8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ______________________________。
(3)写出反应②中生成固体B的离子方程式为_________________________________。
(4)pH < 5时,发生反应有____________________________________(写离子方程式),Na2Cr2O7 + 2KCl = K2Cr2O7↓+ 2NaCl。
下表是相关物质的溶解度数据:
物质 | 溶解度 ( g / 100 g H2O ) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
获得K2Cr2O7晶体的操作由多步组成,依次是加入KCl固体、蒸发浓缩、________________、_____________、洗涤、干燥得到晶体。
(5)某种酒精测试仪中,K2Cr2O7在酸性条件下将乙醇氧化为乙酸,自身被还原为三价铬离子,该反应的氧化剂与还原剂的物质的量比为_________________。
(6)含铬废渣(废水)的随意排放对环境有极大危害,电解法是处理铬污染的一种方法,电解时,在阴极区有Fe(OH)3和Cr(OH)3沉淀生成(已知Ksp[Fe(OH)3] = 4.0×10-38,KspCr(OH)3] = 6.0×10-31)。已知电解后的溶液中c(Cr3+)为3.0×10-5mol/L,则溶液中c(Fe3+)为________________ mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com