

| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水,然后将所得溶液分别置于A、B试管中. | 固体物质全部完全溶解 |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a.如果 b.如果 |
| 步骤3: | 有白色沉淀生成,C的成分有NaCl |
| ||
| ||
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水,然后将所得溶液分别置于A、B试管中. | 固体物质全部完全溶解 |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a.如果 无明显现象,证明固体中不含Na2CO3 b.如果 溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 有白色沉淀生成,C的成分有NaCl |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水,然后将所得溶液分别置于A、B试管中. | 固体物质全部完全溶解 |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a.如果 无明显现象,证明固体中不含Na2CO3 b.如果 溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 有白色沉淀生成,C的成分有NaCl |


科目:高中化学 来源: 题型:
A、CO+CuO
| ||||
| B、2FeCl2+Cl2=2FeCl3 | ||||
| C、CaO+H2O=Ca(OH)2 | ||||
| D、2Al+3CuSO4=3Cu+2Al2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下可使某些金属钝化 |
| B、具有脱水性,故能作干燥剂 |
| C、加热条件下可与木炭反应,其氧化产物为CO2 |
| D、溶于水放出大量的热,稀释的时候应将浓硫酸缓缓加入水中并不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
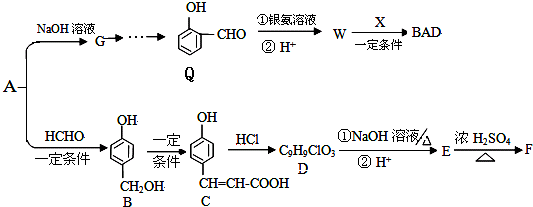
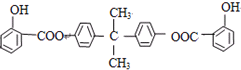
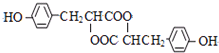
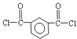 )发生缩聚反应生成一种聚芳酯和氯化氢,写出该聚芳酯的结构简式
)发生缩聚反应生成一种聚芳酯和氯化氢,写出该聚芳酯的结构简式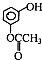
查看答案和解析>>
科目:高中化学 来源: 题型:
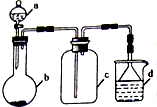 硫酸、盐酸和硝酸并称为工业上的“三大酸”,实验室中也常用三大酸制取某些气体,制取、收集及尾气处理装置如图所示(省略加热装置、夹持和净化装置).仅用此装置和表中提供的部分物质完成相关实验.
硫酸、盐酸和硝酸并称为工业上的“三大酸”,实验室中也常用三大酸制取某些气体,制取、收集及尾气处理装置如图所示(省略加热装置、夹持和净化装置).仅用此装置和表中提供的部分物质完成相关实验.| 序号 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| 甲 | 浓硫酸 | Na2SO3 | ① | ② |
| 乙 | 浓硝酸 | Cu | ③ | NaOH |
| 丙 | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
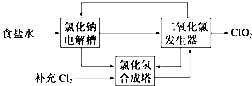
查看答案和解析>>
科目:高中化学 来源: 题型:
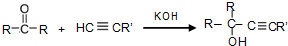
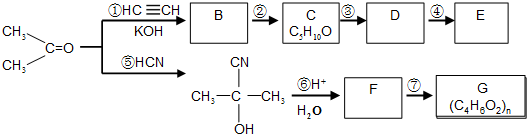
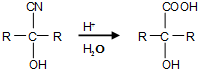
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com