
����Ŀ���أ�31Ga����һ����Ҫ����Ԫ�أ��ؼ��仯�����ڵ��ӹ�ҵ������ӹ�ҵ��������ҵ�ͳ������ϵ��������Ź㷺��Ӧ�á��ش��������⣺
��1����̬Gaԭ��ռ������ܼ����ӵĵ���������ͼ��״Ϊ__________��δ�ɶԵ�����Ϊ________________��
��2��Ga(NO3)3�������ӵ����幹����_____________��д��һ����������ӵ����幹����ͬ�ķ��ӵĻ�ѧʽ___________��
��3��2-��-8-�ǻ�����أ���ͼ��Ӧ���ڷ���ӡ��������2-��-8-�ǻ������������Ԫ�ص縺���ɴ�С��˳����____________________________����Ԫ�ط���)���ṩ�µ��ӶԵijɼ�ԭ����_____________��
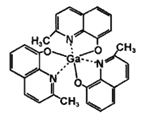
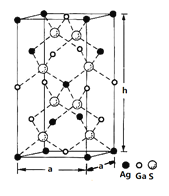
��4��һ�ֹ��ذ뵼����ϵľ����ṹ��ͼ��ʾ�����ء����γɵĻ�����ľ����ǵ���Ϊ�����εij����壬�ṹ����ͼ��ʾ����þ����������λ��Ϊ___________����������ı߳�a=5.75 nm����h=10.30nm���þ����ܶ�Ϊ__________________g��cm-3���г�����ʽ���ɣ���
���𰸡� 1 �Ĵ��Σ��������� ƽ�������� SO3��SeO3 CO32-�ȣ� O N C H Ga N O 4 ![]()
�����������������(1)�����صĻ�̬��������Ų�ʽ1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1����δ�ɶԵ�����������ܲ�ΪN��(2) NO3-��Nԭ�Ӽ۵��Ӷ�����![]() �� sp2����ӻ����������4��ԭ�ӣ�24���۵��ӣ�(3)2-��-8-�ǻ�����غ��е�Ԫ��ΪC��N��O��H��Ga���ǽ�����Խǿ���縺��Խ������ԭ������ԭ�Ӻ��й¶Ե�������������λ����ijԭ�ӣ������ӣ���Χ������������ԭ�ӣ������ӣ������ȸ��ݾ�̯ԭ����㾧����Ħ���������ٸ���
�� sp2����ӻ����������4��ԭ�ӣ�24���۵��ӣ�(3)2-��-8-�ǻ�����غ��е�Ԫ��ΪC��N��O��H��Ga���ǽ�����Խǿ���縺��Խ������ԭ������ԭ�Ӻ��й¶Ե�������������λ����ijԭ�ӣ������ӣ���Χ������������ԭ�ӣ������ӣ������ȸ��ݾ�̯ԭ����㾧����Ħ���������ٸ���![]() �����ܶȣ�
�����ܶȣ�
������(1)�����صĻ�̬��������Ų�ʽ1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1��ֻ��4p�����1������δ�ɶԣ�δ�ɶԵ�����Ϊ1������ܲ�ΪN��������4s��4p�����4sΪ���Σ�4pΪ�����λ�Ĵ�����(2) NO3-��Nԭ�Ӽ۵��Ӷ�����![]() �� sp2����ӻ���û�й¶Ե��ӣ���������Ϊƽ���������Σ��������4��ԭ�ӣ�24���۵���������ȵ�����Ŀ�����SO3��SeO3�ȣ�(3)2-��-8-�ǻ�����غ��е�Ԫ��ΪC��N��O��H��Ga���ǽ�����Խǿ���縺��Խ�����Ե縺���ɴ�С��˳����O��N��C��H ��Ga����ԭ������ԭ�Ӻ��й¶Ե���������������֮���γɹ��ۼ�ʱ�������ṩ�¶Ե����������ṩ�µ��ӶԵijɼ�ԭ����O��N����λ����ijԭ�ӣ������ӣ���Χ����������������ԭ�ӣ������ӣ��������ݾ���ͼ�������������λ��Ϊ4�����ݾ�̯ԭ��������ԭ������8����ԭ������
�� sp2����ӻ���û�й¶Ե��ӣ���������Ϊƽ���������Σ��������4��ԭ�ӣ�24���۵���������ȵ�����Ŀ�����SO3��SeO3�ȣ�(3)2-��-8-�ǻ�����غ��е�Ԫ��ΪC��N��O��H��Ga���ǽ�����Խǿ���縺��Խ�����Ե縺���ɴ�С��˳����O��N��C��H ��Ga����ԭ������ԭ�Ӻ��й¶Ե���������������֮���γɹ��ۼ�ʱ�������ṩ�¶Ե����������ṩ�µ��ӶԵijɼ�ԭ����O��N����λ����ijԭ�ӣ������ӣ���Χ����������������ԭ�ӣ������ӣ��������ݾ���ͼ�������������λ��Ϊ4�����ݾ�̯ԭ��������ԭ������8����ԭ������![]() ����ԭ������
����ԭ������![]() ��������Ħ��������
��������Ħ��������![]() �������������
�������������![]() ��
��![]() ��
��


 ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д� Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����ѡ���ȷ���ǣ��� ����
A.��֪A����H2B��������= HA��HB�� �� ����H����������HB����A����B2��
B.��0.1 mol/L��ˮ�еμ�0.1 mol/L���ᣬǡ����ȫ�к�ʱ��ҺpH=a �� ����ˮ���������c��OH����=10��a mol/L
C.��c molL��1�Ĵ�����Һ��0.02 molL��1NaOH��Һ�������Ϻ���Һǡ�ó����ԣ��ú�c�Ĵ���ʽ��ʾCH3COOH�ĵ��볣��Ka= ![]()
D.����ȥCuCl2��Һ�л���������FeCl3 �� �ɼ���CuO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���(ICl3)��ҩ��ϳ�����;�dz��㷺,���۵�Ϊ33��,�е�Ϊ73�档ʵ���ҿ�����ͼװ����ȡICl3��

(1)����a��������______��
(2)�Ʊ�����ѡ�õ�ҩƷΪƯ�۹���(��Ҫ�ɷ��ڴ������)��Ũ����,��ط�Ӧ�Ļ�ѧ����ʽΪ_______��
(3)װ��B�����ڳ���,Ҳ�ǰ�ȫƿ.�ܼ��ʵ�����ʱװ��C���Ƿ�������,��д����������ʱB�е�����_________��
(4)�Լ�YΪ_______��
(5)�����뵥�ʵ������¶��Ե���70���·�Ӧ����װ��D���˵ļ��ȷ�ʽΪ______��
(6)���ⶨ����ʵ���Ʊ�ICl3��Ʒ��ICl3�Ĵ��ȣ�ȷ��ȡICl3��Ʒ10.0g���ձ���,��������ˮ����KI���壬��ַ�Ӧ����I2(��Ʒ�����ʲ���Ӧ)��
��д���÷�Ӧ�����ӷ���ʽ________��
�ڽ�������Һ���ó�100mL����Һ��ȡ25.00mL����Һ����2.0mol/L��Na2S2O3��Һ�ζ�(I2+2S2O32-=2I-+S4O62-)��������Na2S2O3��Һ�����Ϊ20.00mL,�����Ʒ��ICl3����������Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ͽ��������ԭ��صĻ�ѧ��Ӧ�� ( )
A.2Al(s)ʮ2NaOH(aq)+2H2O(1)��2NaAlO2(ag)+3H2(g)����H <0
B.Ba(OH)2��8H2O(s)+2NH4Cl(s)��BaCl2(aq)+2NH3��H2O(aq)+8H2O(1)����H >0
C.CaC2(s)+2H2O(1)��Ca(OH)2(s)+C2H2(g)����H <0
D.FeCl3(aq)ʮ3H2O(1) ![]() Fe(OH)3(s)+3HCl(aq)����H >0
Fe(OH)3(s)+3HCl(aq)����H >0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£��������O3��O2��ͬ���ǣ� ��
A.����B.������C.ԭ����D.�ܶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����з�Ӧ���Ȼ�ѧ����ʽ��
��1��N2��H2��Ӧ����34g NH3 �� �ų�92kJ������
��2��1molCH4(g)��O2����ȫȼ������CO2��H2O(g)���ų�890��3kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������2mol������̼��������ȷ���ǣ� ������
A.���Ϊ44.8LB.����4molԭ��
C.������Ϊ6.02��1023D.����Ϊ88g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1mol H2O��˵����ȷ���ǣ� ��
A.����6.02��1023�������B.����6.02��2��1023����Ԫ��
C.����Ϊ18gD.��ԭ������ԭ�ӵ�����֮��Ϊ2:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��������ڻ�ѧԪ�ص�������������ǣ� ��
A.ͬһ�����岻ͬ��֯ϸ���ڻ�ѧԪ������ͺ���������ͬ
B.C��H��O��N�������������ø�������Ԫ��
C.�������е�SԪ�ش����ڰ������R����
D.ռϸ������������Ԫ����O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com