
【题目】常温下,下列选项不正确的是( )
A.已知A-+H2B(过量)= HA+HB- , 则结合H+的能力:HB-<A-<B2-
B.在0.1 mol/L氨水中滴加0.1 mol/L盐酸,恰好完全中和时溶液pH=a , 则由水电离产生的c(OH-)=10-a mol/L
C.将c molL-1的醋酸溶液与0.02 molL-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka= ![]()
D.欲除去CuCl2溶液中混有少量的FeCl3 , 可加入CuO
【答案】A
【解析】H2B过量,A-+H2B(过量)= HA+HB-,只能证明结合H+的能力HB-<A-,不能证明结合H+的能力A-<B2-,故A符合题意;
在0.1 mol/L氨水中滴加0.1 mol/L盐酸,恰好完全中和时,溶质是氯化铵,氯化铵水解促进水电离,溶液pH=a,则由水电离产生的c(OH-)=10-a mol/L,故B不符合题意;
将c molL-1的醋酸溶液与0.02 molL-1NaOH溶液等体积混合后溶液恰好呈中性c(OH-)= c(H+)=10-7 mol/L,c(Na+)=0.01 mol/L,根据电荷守恒c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),则c(CH3COO-)=0.01 mol/L,根据物料守恒,c(CH3COOH)=( ![]() -0.01) mol/L, CH3COOH的电离常数Ka=
-0.01) mol/L, CH3COOH的电离常数Ka= ![]() ,故C不符合题意;
,故C不符合题意;
欲除去CuCl2溶液中混有少量的FeCl3,可加入CuO使溶液PH升高,促进铁离子水解,生成氢氧化铁沉淀,故D不符合题意。
所以答案是:A
【考点精析】本题主要考查了化学平衡常数的含义的相关知识点,需要掌握指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度不变的状态才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中钨主要以钨酸盐( 钨元素的化合价为+6)形式存在于黑钨矿中。黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4 ),还含有少量Si、As的化合物。由黑钨矿石冶冻金属钨的工艺流程如图所示:
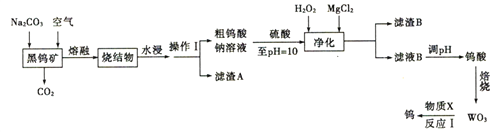
已知:①烧结物的成分为Fe2O3、MnO2、Na2SO3、Na2WO4、Na3AsO3、Na3AsO4;
②上述流程中,钨的化合价只在反应Ⅰ中发生改变;
③常温下钨酸难溶于水。
请回答下列问题:
(l)操作Ⅰ用到的玻璃仪器为______________。
(2)写出FeWO4在熔融条件下与Na2CO3、空气反应生成Fe2O3 的化学方程式________________。
(3)pH=10的溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-等,则“净化”过程中,MgCl2 的作用是______________,加入H2O2 时发生反应的离子方程式为____________________。
(4)已知:室温时Ksp[Mg(OH)2]=5.6×10-12,在“净化”阶段,常温时保持溶液pH=10,为防止产生Mg(OH)2 沉淀,溶液中c(Mg2+)应不超过_________mol/L。
(5)反应Ⅰ中,物质X 可为H2、CO。
①已知:C(s)+H2O(g)![]() CO(g)+H2(g) △H1=a kJ/mol
CO(g)+H2(g) △H1=a kJ/mol
W3(s)+3H2(g)![]() W(s)+3H2O (g) △H2=bkJ/mol
W(s)+3H2O (g) △H2=bkJ/mol
WO3(s)+3CO(g)![]() W(s)+3CO2(g) △H3=c kJ/mol
W(s)+3CO2(g) △H3=c kJ/mol
根据上述信息,2WO3(s)+3C(s)![]() 2W(s)+3CO2(g)的△H=____________kJ/mol(用含a、b、c的式子表示)。
2W(s)+3CO2(g)的△H=____________kJ/mol(用含a、b、c的式子表示)。
②若黑钨矿中钨的质量分数为ω,提炼过程中利用率为b,欲用akg 黑钨矿制得化学纯金属钨,则产品中杂质允许含量的最大值为_____________kg(化工产品等级标准:优级纯≥99.8%,分析纯≥99.7%,化学纯≥99.5%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应、产生白雾和带有制激性气味的气体。实验室合成SOCl2的原理为:SO2+Cl2+SCl2 ![]() 2SOCl2,部分装置如图所示。
2SOCl2,部分装置如图所示。
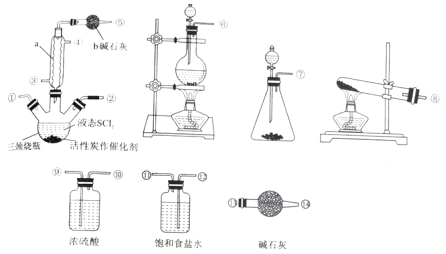
回答下列问题:
(1)仪器a 的名称是_______,装置b 的作用是__________。
(2)实验室制取SOCl2 时,所选仪器的连接顺序是⑥→______→①②←_____(某此仪器可以多次使用)。
(3)冷凝管口③是_____(填“进水”或“出水”)口,本实验中制备氯气的离子方程式为___________。
(4)将SOCl2 与AlCl3·6H2O混合加热,可得到无水AlCl3,试解释原因________。
(5)已知SCl2 的沸点为50℃。实验结束后,将三颈烧瓶中的混合物分离开的实验操作名称是___。若反应中消耗标准状况下的Cl2的体积为1120 mL,最后得到纯净的SOCl26.76 g,则SOCl2 的产率为________(保留三位有效数字)。
(6)已知:SOCl2 +4NaOH= Na2SO3+2NaCl +2H2O。请设计简单的实验(可选试剂:稀盐酸、稀硝酸、氯化钡溶液、硝酸钡溶液、硝酸银溶液、品红溶液) 来验证氯化亚砜与NaOH 溶液反应后的溶液中存在Cl-__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(g) ![]() cC(g)+dD(g)△H=Q,同时符合下列两图中各曲线的规律是( )
cC(g)+dD(g)△H=Q,同时符合下列两图中各曲线的规律是( )
A.a+b>c+d T1>T2 Q>0
B.a+b>c+d T1<T2 Q<0
C.a+b<c+d T1<T2 Q>0
D.a+b>c+d T1>T2 Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸艾司洛尔,主要用于急性心肌局部缺血症的治疗,对急性心肌梗塞有明显的疗效。其合成新路线如下: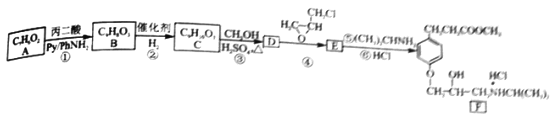
已知:①
②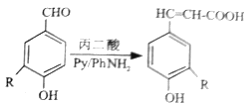
(1)A的名称是______,B 含有的官能团是______,②的反应类型是_______。
(2)写出反应③的化学方程式___________。
(3)E 的结构简式为___________。
(4)F物质可溶于水,原因是__________。
(5)与B 具有相同的官能团且苯环上有三侧链的同分异构体,其总数目为______。
(6)参照E 物质的合成路线,以 和
和 为主要原料合成制备
为主要原料合成制备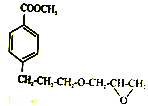 ,写出其合成路线_________。
,写出其合成路线_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2 , 在500℃下发生发应,CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
CH3OH(g)+ H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=。
(2)500℃该反应的平衡常数为(结果保留一位小数),图2是改变温度时化学反应速率随时间变化的示意图,若提高温度到800℃进行,达平衡时,K值(填“增大”“减小”或“不变”)。
(3)下列措施中不能使CO2的转化率增大的是________________。
A.在原容器中再充入1mol H2
B.在原容器中再充入1molCO2
C.缩小容器的容积
D.使用更有效的催化剂
E.将水蒸气从体系中分离出
(4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正) v(逆)(填“>”“<”或“=”)。
Ⅱ、一定条件下,可逆反应A2(g)+B2(g) ![]() 2C(g)达到平衡时,各物质的平衡浓度为c(A2)=0.5mol/L;c(B2)=0.1mol/L;c(C)=1.6mol/L。若用a、b、c分别表示A2、B2、C的初始浓度(mol/L),则:
2C(g)达到平衡时,各物质的平衡浓度为c(A2)=0.5mol/L;c(B2)=0.1mol/L;c(C)=1.6mol/L。若用a、b、c分别表示A2、B2、C的初始浓度(mol/L),则:
①a、b应满足的关系是; ②a的取值范围是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+2Ag。下列有关说法正确的是( )

A. 测量原理示意图中,电流方向从Cu流向Ag2O
B. 负极的电极反应式为2Cu+2OH--2e-=Cu2O+H2O
C. 电池工作时,OH-向正极移动
D. 2molCu与1molAg2O的总能量低于1molCu2O与2molAg具有的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓(31Ga)是一种重要金属元素,镓及其化合物在电子工业、光电子工业、国防工业和超导材料等领域有着广泛的应用。回答下列问题:
(1)基态Ga原子占据最高能级电子的电子云轮廓图形状为__________,未成对电子数为________________。
(2)Ga(NO3)3中阴离子的立体构型是_____________,写出一个与该阴离子的立体构型相同的分子的化学式___________。
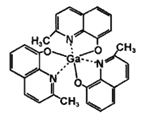
(3)2-甲基-8-羟基喹啉镓(如图)应用于分子印迹技术,2-甲基-8-羟基喹啉镓中五种元素电负性由大到小的顺序是____________________________(填元素符号),提供孤电子对的成键原子是_____________。
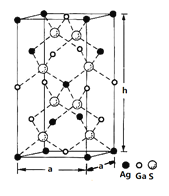
(4)一种硅镓半导体材料的晶胞结构如图所示由硫、镓、银形成的化合物的晶胞是底面为正方形的长方体,结构如下图所示,则该晶体中硫的配位数为___________,晶胞底面的边长a=5.75 nm,高h=10.30nm,该晶体密度为__________________g·cm-3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com