
 H++A2-回答下列问题:
H++A2-回答下列问题: HA-+OH-
HA-+OH- HA-+OH-。
HA-+OH-。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.醋酸与醋酸钠的混合溶液中:c(CH3COO-)+ c(OH-) = c(Na+) + c(H+) |
| B.1 mol·L-1Na2CO3溶液中:c(OH-) = c((H+) + c(HCO3-) + c(H2CO3) |
| C.0.1 mol·L-1的硫酸铵溶液中:c(SO42-) >c(NH4+)>c(H+)> c(OH-) |
| D.将1molKCl、1molNaHS溶于水配成1L混合溶液中: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A) | 0.20 | 0.14 | b | 0.09 | 0.09 | 0.09 |
| c(B) | 0.00 | 0.12 | 0.20 | c | d | e |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.太阳能电池利用太阳能的方式是光—电转换 |
| B.生物质能本质上是太阳能 |
| C.寻找高效催化剂,使水分解出产物氢气,同时释放能量 |
| D.利用太阳能、风能和氢能等能源替代化石能源可以改善空气质量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.X、Y两种碱溶液中溶质的物质的量浓度一定相等 |
| B.稀释后,X溶液的碱性比Y溶液的碱性强 |
| C.分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积Vx>Vy |
| D.若8<a<10,则X、Y都是弱碱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
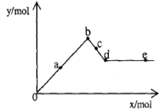
| A.a时沉淀的质量为3.495 g |
| B.b时沉淀的物质的量为0.05 mol |
| C.c时溶液中Ba2+离子的物质的量为0.005 mol |
| D.e时溶液中AlO2—的物质的量为0.01 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
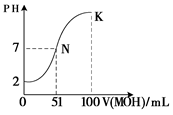
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.29 | B.29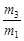 | C.29 | D.29 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com