
| A. | 化学家哈伯用催化法合成氨后,就能生产硝酸铵 | |
| B. | 化学家合成碳纳米管,用作分子导线和超小型电子器件 | |
| C. | 俄国科学家门捷列夫发现元素周期律 | |
| D. | 诺贝尔用硝化甘油制成了炸药,并用于工业生产 |
分析 A.硝酸铵用作化肥,制造炸药;
B.碳纳米管,用作分子导线和超小型电子器件,能用于制造超小型的电子产品;
C.元素周期律研究元素的性质和发现新元素;
D.硝化甘油制成了炸药,可用与采矿、制造武器等.
解答 解:A.化学家哈伯用催化法合成氨后,氨气氧化生成NO,NO生成二氧化氮,最终能生成硝酸铵,硝酸铵用作化肥,制造炸药,能说明化学具有创造性和实用性,故A不选;
B.碳纳米管,用作分子导线和超小型电子器件,能用于制造超小型的电子产品,能说明化学具有创造性和实用性,故B不选;
C.元素周期律研究元素的性质和发现新元素,主要用于化学的理论研究,不能说明化学具有创造性和实用性,故C选;
D.诺贝尔用硝化甘油制成了炸药,炸药可用与采矿、制造武器等,能说明化学具有创造性和实用性,故D不选.
故选C.
点评 本题考查了化学知识在生产生活中的应用,题目难度不大,了解化学的发展历史,关注化学学科成就,有利于激发学生学习化学的兴趣,培养学生的社会责任感.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2016-2017学年四川省高二上教学质检化学试卷(解析版) 题型:填空题
A、B、C、D、E是五种短周期元素,F是过渡元素。A、B、C、E同周期,C、D同主族,A元素在地壳含量中排名第二,B是同周期第一电离能最小的元素,C原子的最外层有三个未成对电子,E单质常温下为淡黄色固体,F的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的名称:A B 。
(2)B、C、E第一电离能由大到小的顺序是 (用元素符号作答)。
(3)写出D元素原子构成单质的电子式 ,D的简单气态氢化物的空间构型为 。
(4)F元素在周期表中的位置为 ,其形成的简单离子F3+的核外电子排布式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
在配制Fe2(SO4)3溶液时,为了防止水解,常常往溶液中加入少量的( )
A.NaOH B.H2SO4 C.KCl D.CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
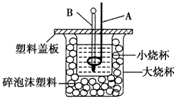 已知 H+(aq)+OH-(aq)═H O(l)△H=-57.3kJ•mol-1,回答下列有关中和反应的问题:(1)用 0.1mol Ba(OH)2 配成稀溶液与足量稀硝酸反应,能放出11.46kJ 的能量.
已知 H+(aq)+OH-(aq)═H O(l)△H=-57.3kJ•mol-1,回答下列有关中和反应的问题:(1)用 0.1mol Ba(OH)2 配成稀溶液与足量稀硝酸反应,能放出11.46kJ 的能量.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) (△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)(△H=+57.3 kJ/mol (中和热) | |
| C. | S(s)+O2(g)=SO2(g) (△H=-269.8 kJ/mol (反应热) | |
| D. | 2NO2=O2+2NO (△H=+116.2 kJ/mol (反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com