
【题目】(1)肼(N2H4)是火箭推进器中常用的高能燃料,已知0.4mol液态肼和足量H2O2反应,生成N2和水蒸气,放出256.65kJ的热量,请写出该反应的热化学方程式:__________________________。
(2)工业上制氢气的一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g)
已知在25℃时:C(石墨)+ ![]() O2(g)=CO(g)△H1=-111kJ·mol-1
O2(g)=CO(g)△H1=-111kJ·mol-1
H2(g)+ ![]() O2(g)=H2O(g)△H2=-242kJ·mol-1
O2(g)=H2O(g)△H2=-242kJ·mol-1
C(石墨)+O2(g)=CO2(g)△H3=-394kJ·mol-1
试计算25℃时一氧化碳与水作用转化为氢气和二氧化碳反应的反应热△H=________kJ·mol-1
(3)高铁酸钾(K2FeO4)可作净水剂,也可用于制造高铁电池。高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O=3Zn(OH)2+Fe(OH)3+4KOH,该电池放电时正极反应式为____________。
(4)用该电池电解100mL1mol·L-1的AgNO3溶液,写出电解反应方程式:____________________。当电路中通过0.01mol电子时,被电解溶液的pH为________(溶液体积变化忽略不计)。
【答案】 N2H4(l)+2H2O(l)=N2(g)+4H2O△H=-641.625kJ/mol -41 FeO42-+4H2O+3e-=Fe(OH)3+5OH- 4AgNO3+2H2O=4Ag+O2+4HNO3 1
【解析】(1)0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,则热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJmol-1,故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJmol-1;
(2)①C(石墨)+ ![]() O2(g)=CO(g)△H1=-111kJ·mol-1,②H2(g)+
O2(g)=CO(g)△H1=-111kJ·mol-1,②H2(g)+ ![]() O2(g)=H2O(g)△H2=-242kJ·mol-1,③C(石墨)+O2(g)=CO2(g)△H3=-394kJ·mol-1,依据盖斯定律③-②-①得到:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol;故答案为:-41;
O2(g)=H2O(g)△H2=-242kJ·mol-1,③C(石墨)+O2(g)=CO2(g)△H3=-394kJ·mol-1,依据盖斯定律③-②-①得到:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol;故答案为:-41;
(3)根据总反应3Zn+2K2FeO4+8H2O=3Zn(OH)2+Fe(OH)3+4KOH,高铁酸钾在正极得到电子,发生还原反应,电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-,故答案为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-;
(4)该电池电解100mL 1molL-1的AgNO3溶液,阳极: 2H2O—4e- = O2↑+ 4H+,阴极:4Ag+ + 4e- = 4Ag↓,总方程式:4AgNO3 + 2H2O ![]() 4Ag↓+ O2↑+ 4HNO3。根据阳极的电极反应:2H2O—4e- = O2↑+ 4H+,所以产生的H+的物质的量为0.01mol,其物质的量浓度为
4Ag↓+ O2↑+ 4HNO3。根据阳极的电极反应:2H2O—4e- = O2↑+ 4H+,所以产生的H+的物质的量为0.01mol,其物质的量浓度为![]() =0.1mol/L,所以pH=1,故答案为:4AgNO3+2H2O=4Ag+O2+4HNO3;1。
=0.1mol/L,所以pH=1,故答案为:4AgNO3+2H2O=4Ag+O2+4HNO3;1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为了除去KCl固体中少量MgSO4和CaCl2杂质.某同学进行了下列七项操作,正确的操作顺序是( )
①加水溶解 ②加热蒸发得到晶体 ③加入过量BaCl2溶液 ④加入过量盐酸 ⑤加入过量K2CO3⑥过滤 ⑦加入过量KOH.
A.①⑤③⑦⑥④②
B.①⑤⑦③④⑥②
C.①⑦③⑤⑥④②
D.①⑦③④⑥⑤②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示渗透作用装置图,其中半透膜为膀胱膜,甲、丙装置中A、B、a、b溶液浓度分别用MA、MB、Ma、Mb表示,乙、丁装置分别表示一段时间后甲、丙装置的状态,液面上升的高度分别为h1、h2。如果A、B、a、b均为蔗糖溶液,且MA>MB,Ma=Mb>MA,则达到平衡后( )


A. h1>h2、Ma>MbB. h1>h2、Ma<Mb
C. h1<h2、Ma<MbD. h1<h2、Ma>Mb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能够鉴定卤代烃中卤元素存在的操作是 ( )
A. 在卤代烃中直接加入AgNO3溶液
B. 加蒸馏水,充分搅拌后,加入AgNO3溶液
C. 加入NaOH溶液加热后,再加入AgNO3溶液
D. 加入NaOH溶液加热后加入稀硝酸酸化,再加入AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4.0 g NaOH和5.3 g Na2CO3混合并配成溶液,向溶液中逐滴缓慢滴加0.5 mol/L稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的体积(标况下)的关系的是
A.  B.
B. 
C.  D.
D. 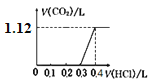
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在下列溶液中可能大量共存的离子组是
A. pH=0的溶液:Fe2+、Mg2+、NO3-、SO42-
B. 在滴加石蕊试液后呈红色的溶液中:Na+、K+、Al3+、CO32-
C. ![]() 的溶液中:NH4+、SO42-、NO3-、CO32-
的溶液中:NH4+、SO42-、NO3-、CO32-
D. 由水电离出的c(H+)=1×10-13mol/L的溶液:Al3+、NH4+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的恒容密闭容器中发生反应xA(g)+ yB(g)![]() zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是
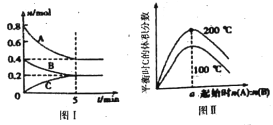
A. 图II所知反应xA(g)+yB(g) ![]() zC(g) △H<0,且a=2
zC(g) △H<0,且a=2
B. 200℃时,该反应的平衡常数为25
C. 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol/(Lmin)
D. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
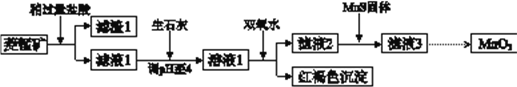
已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是_________。盐酸溶解MnCO3的化学方程式是_________。
(2)向溶液1中加入双氧水时,反应的离子方程式是___________。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是__________。
(4)将MnCl2转化为MnO2的一种方法是氧化法。用酸化的NaClO3溶液将MnCl2氧化生成MnO2和Cl2,该反应的离子方程式为___________。
(5)将MnCl2转化为MnO2的另一种方法是电解法。
① 生成MnO2的电极反应式是___________。
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是_________。
③ 若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com