
【题目】某课外小组对金属钠进行研究。已知C、D都是单质,F的水溶液是一种常见的强酸。
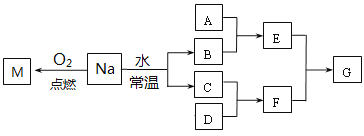
(1)金属Na在空气中放置足够长时间,最终的生成物是:_________________________。
(2)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_________________________。
(3)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,请写出该过程发生反应的方程式:_________________________。
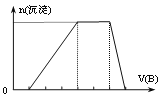
(4)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其物质的量浓度之比为________________________。
(5)将NaHCO3与M的混合物在密闭容器中充分加热后排出气体,经测定,所得固体为纯净物,则NaHCO3与M的质量比为____________。
【答案】碳酸钠 或Na2CO3 溶液中逐渐有白色絮状沉淀生成且不断增加;然后又由多到少最后沉淀消失 4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓ c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3 大于或等于≥168: 78
【解析】
根据转化关系图可知:2Na+O2![]() Na2O2确定M为Na2O2;2Na+2H2O=2NaOH+H2↑,C、D都是单质,F的水溶液是一种常见的强酸,确定B为NaOH,C为H2,D为Cl2,F为HCl。结合题干问题分析解答。
Na2O2确定M为Na2O2;2Na+2H2O=2NaOH+H2↑,C、D都是单质,F的水溶液是一种常见的强酸,确定B为NaOH,C为H2,D为Cl2,F为HCl。结合题干问题分析解答。
(1)Na在空气中放置足够长时间,发生4Na+O2=2Na2O、Na2O+H2O=2NaOH、2NaOH+CO2=Na2CO3+H2O、Na2CO3+10H2O=Na2CO310H2O、Na2CO310H2O=Na2CO3+10H2O,则最终生成物为Na2CO3;
(2)若A是一种常见金属单质,能与NaOH反应,则A为Al,E为NaAlO2,将过量的F(HCl)溶液逐滴加入E(NaAlO2)溶液,边加边振荡,发生NaAlO2+HCl+H2O=NaCl+Al(OH)3↓、Al(OH)3+3HCl=AlCl3+3H2O,所看到的实验现象是溶液中逐渐有白色絮状沉淀生成,且不断增加,然后又由多到少,最后消失;
(3)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则A为可溶性亚铁盐,E为Fe(OH)3,则A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E这一过程的离子方程式为4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓。
(4)A加入氢氧化钠溶液,分析图象可知:第一阶段是H++OH-=H2O,所以溶液呈酸性,不可能存在CO32-;第二阶段金属阳离子与氢氧根离子生成沉淀,第三阶段应该是NH4++OH-=NH3H2O;第四阶段氢氧化物沉淀与氢氧化钠反应最后全溶解,肯定没有Mg2+、Fe3+,必有Al3+。由此确定溶液中存在的离子H+、NH4+、Al3+、SO42-;假设图象中横坐标一个小格代表1molNaOH,则根据前三阶段化学方程式:H++OH-=H2O,Al3++3OH-=Al(OH)3,NH4++OH-=NH3H2O,可知n(H+)=1mol,n(Al3+)=1mol,n(NH4+)=2mol,再利用电荷守恒n(SO42-)×2=n(H+)×1+n(Al3+)×3+n(NH4+)×1,得出n(SO42-)=3mol,根据物质的量之比等于物质的量浓度之比得到c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3。
(5)将NaHCO3与M(过氧化钠)的混合物在密闭容器中充分加热发生的反应有三个:2NaHCO3![]() Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,所得固体为纯净物,说明碳酸氢钠加热分解的二氧化碳必须把过氧化钠反应完,则根据总的方程式可知
Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,所得固体为纯净物,说明碳酸氢钠加热分解的二氧化碳必须把过氧化钠反应完,则根据总的方程式可知
4NaHCO3+2Na2O2![]() 4Na2CO3+2H2O+O2↑
4Na2CO3+2H2O+O2↑
84×4g 78×2g
m(NaHCO3):m(Na2O2)=(84×4g):(78×2g)=168:78(或84:39)。由于碳酸氢钠可以过量,得到的还是纯净物:2NaHCO3![]() Na2CO3+CO2↑+H2O↑,所以m(NaHCO3):m(Na2O2)≥168:78(或84:39)。
Na2CO3+CO2↑+H2O↑,所以m(NaHCO3):m(Na2O2)≥168:78(或84:39)。
答案:大于或等于168:78(或84:39)。


科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向。CO2可转化成有机物实现碳循环。在 2 L 的恒温恒容密闭容器中,充入 2molCO2 和 6molH2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得 CO2 和 CH3OH(g)的浓度随时间变化如图:
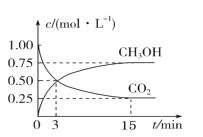
(1)从 3 min 到 15min,υ(H2)=____molL-1min-1;
(2)能说明上述反应达到平衡状态的是_____填编号)。
A. 反应中 CO2 与 CH3OH 的物质的量浓度之比为 1∶1(即图中交叉点)
B. 混合气体的压强不随时间的变化而变化
C. 单位时间内生成 1mol H2,同时生成 1mol CH3OH
D. 混合气体的平均密度不随时间的变化而变化
(3)平衡时 CO2 的转化率为 _____。
(4)平衡混合气体中 CO2(g)和 H2(g)的物质的量之比是 ______。
(5)第 3 分钟时υ正(CH3OH)______第 15 分钟时υ逆(CH3OH)(填“>”、“<” “=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为________,其中M原子的配位数为________。
(2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是________(写元素符号)。
(3)M与Y形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为________,已知晶胞参数a=0.542 nm,此晶体的密度为__________g·cm-3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②此化合物的氨水溶液遇到空气被氧化为深蓝色,其中阳离子的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C. M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D. 在M–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过以下装置测定M样品(只含Fe、Al、Cu)中各成分的质量分数。取两份质量均为m g的M样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为V1 mL和V2 mL(已折算到标准状况下)。

(1)写出实验1中发生反应的离子方程式:______________________________。
(2)实验1装置中小试管的作用是___________________________________________________。
(3)对于实验2,平视读数前应依次进行的两种操作是:①___________________②___________________。
(4)M样品中铜的质量的数学表达式为(用m 、V1和V2 表示):__________________________。
(5)实验1进行实验前,B瓶中水没有装满,使测得气体体积____________ (填“偏大”、“偏小”或“无影响”,下同);若拆去实验2中导管a,使测得气体体积___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌纽扣电池如图,电池反应式为:![]() ,下列说法正确的是( )
,下列说法正确的是( )
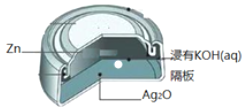
A.锌作负极
B.电池工作时,电流从Zn经导线流向Ag2O
C.正极发生还原反应
D.负极的电极反应式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将n mol·L-1氨水滴入10 mL 1.0 mol·L-1 盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是

A. a点KW=1.0×10-14
B. b点:c(NH)>c(Cl-)>c(H+)>c(OH-)
C. 25 ℃时,NH4Cl水解常数为(n-1)×10-7(用n表示)
D. d点水的电离程度最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com