
【题目】实验室用H2SO4滴定氨水,选用的指示剂是( )
A.甲基橙
B.石蕊
C.酚酞
D.任选一种均可以
科目:高中化学 来源: 题型:
【题目】2013年初天津连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)利用钠碱循环法可脱除烟气中的SO2 . ①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 .
②吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:l | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显性(填“酸”、“碱”或“中”),用化学平衡原理解释: .
③当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:
写出HSO3﹣在阳极放电的电极反应式: , 当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.
(2)用CH4催化还原NOx可以消除氮氧化物的污染.例如: CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H=﹣574kJmol﹣1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=﹣1160kJmol﹣1
若用标准状况下4.48L CH4还原NO2至N2 , 整个过程中转移的电子总数为(阿伏伽德罗常数的值用NA表示),放出的热量为kJ.
(3)工业上合成氮所需氢气的制备过程中,其中的一步反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g);△H<0 一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6,则平衡常数K= .
CO2(g)+H2(g);△H<0 一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6,则平衡常数K= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①利用VSEPR模型推断分子或离子的立体构型。
CS2;
AlBr3(共价分子)。
②有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式: ;
; 。
。
③按要求写出第二周期非金属元素构成的中性分子的化学式。
平面形分子,三角锥形分子,四面体形分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下,向盛有食盐的2L恒容密闭容器中加入0.2molNO2、0.2molNO和0.1molCl2 , 发生如下两个反应: ①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)△H1<0 平衡常数K1
②2NO(g)+Cl2(g)2ClNO(g)△H2<0 平衡常数K2
10min时反应达到平衡,测得容器内体系的压强减少20%,10min内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10﹣3mol/(Lmin).下列说法不正确的是( )
A.反应4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数为K12/K2
B.平衡后c(Cl2)=2.5×10﹣2mol/L
C.其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大
D.平衡时NO2的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质有以下转化关系: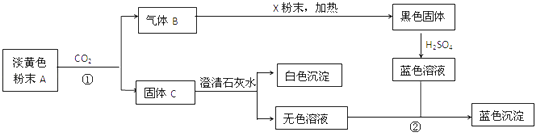
根据上图和实验现象,回答下列问题:(用化学式表示)
(1)A是 , B是 , C是 , X粉末是 .
(2)写出反应①的化学方程式 .
(3)写出反应②的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列电子排布式判断,处于激发态的原子是
A. 1s22s22p6B. 1s22s22p63s1C. 1s22s23s1D. [Ar]3d14s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示: 其中M为储氢合金,MH为吸附了氢原子的储氢合金,KOH溶液作电解液.关于镍氢电池,下列说法不正确的是( )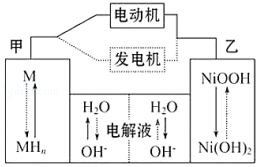
A.充电时,阴极附近pH降低
B.电动机工作时溶液中OH﹣向甲移动
C.放电时正极反应式为:NiOOH+H2O+e﹣═Ni(OH)2+OH﹣
D.电极总反应式为:MH+NiOOH ![]() M+Ni(OH)2
M+Ni(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com