
����Ŀ��H2O2����ɫ�������������Խ������ɸ�ǿ�������ԣ�������ˮ�������ԣ�������K1=1��10��12 �� K2=1��10��25 �� �ش��������⣺
��1��������ˮ�ĵ���ƽ��ij���KԼΪ �� K��K1��K2�Ӵ�С˳��Ϊ��
��2���������������������£�H2O2��Һ���ѱ���C6H6������Ϊ���ӣ�C6H5OH������Ӧ��Ļ���ᆳ��������õ����ӣ���������ȡ1mol������Ҫ����H2O2mol��ʵ�����Ĵ���������������Ҫԭ����
��3��K4[Fe��CN��6]����ɫ��Һ����K3[Fe��CN��6]������ɫ��Һ����һ����H2O2��ɵĻ�����������ڻ����Һ��pH������ֻ�ɫ������ɫ����仯�����մ����������Ե�˳�ɹ۲쵽����������
��4����ҵ��H2O2��ȥ��ˮ�е�Cl2 �� ��������������SO2��Cl2��ȣ����ŵ��� ��
���𰸡�
��1��56��10��14��K1��K��K2
��2����Һ��1�����Ӳ��ȶ��ױ�����
��3����Һ�ɻ���ɫ��Ϊ��ɫ
��4��O2�����������Լ�H2O2�����ų��ж����壬�ҷ�ˮ���Խ���
���������⣺��1��������ˮ��Kw=1��10��14 �� �����ƽ��ij���KԼΪ56��10��14 �� H2O2��K1=1��10��12 �� K2=1��10��25 �� K��K1��K2�Ӵ�С˳��ΪK1��K��K2 �� ���Դ��ǣ�56��10��14��K1��K��K2����2������H2O2+C6H6 ![]() C6H5OH+H2O�����ӡ�����ˮ�ֲ㣬��Ӧ��Ļ���ᆳ����Һ������õ����ӣ��ɷ�Ӧ��֪����������ȡ1mol������Ҫ����H2O2 Ϊ1mol��ʵ�����Ĵ���������������Ҫԭ���DZ��Ӳ��ȶ��ױ������������ĵĹ�������Ͷ࣬
C6H5OH+H2O�����ӡ�����ˮ�ֲ㣬��Ӧ��Ļ���ᆳ����Һ������õ����ӣ��ɷ�Ӧ��֪����������ȡ1mol������Ҫ����H2O2 Ϊ1mol��ʵ�����Ĵ���������������Ҫԭ���DZ��Ӳ��ȶ��ױ������������ĵĹ�������Ͷ࣬
���Դ��ǣ���Һ��1�����Ӳ��ȶ��ױ���������3����2H++[Fe��CN��6]4������ɫ��Һ��+H2O2[Fe��CN��6]3��������ɫ��Һ��+2H2O������������ƽ�������ƶ�������������ƽ�������ƶ������մ����������Ե�˳�ɹ۲쵽����������Һ�ɻ���ɫ��Ϊ��ɫ��
���Դ��ǣ���Һ�ɻ���ɫ��Ϊ��ɫ����4����H2O2��ȥ��ˮ�е�Cl2 �� ����H2O2+Cl2=2HCl+O2��֪��OԪ��ʧȥ���ӣ���Ӧ��������ΪO2 �� SO2��ȥ��ˮ�е�Cl2 �� ����Cl2+SO2+2H2O=H2SO4+2HCl������SO2��Cl2��ȣ����ŵ��ǹ��������Լ�H2O2�����ų��ж����壬�ҷ�ˮ���Խ�����
���Դ��ǣ�O2�����������Լ�H2O2�����ų��ж����壬�ҷ�ˮ���Խ�����
�����㾫����������Ҫ�����˻�ѧƽ��ļ�������֪ʶ�㣬��Ҫ���շ�Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%������ȷ�����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���桢�����ѡ����䲻����ѧ�γ����Ľ���Ԫ�أ����ڹ�ҵ������������Ҫ���ã�
��1���������� ��CeO2����ƽ�������ʾ����������ҪӦ�ã�CeO2��ϡ�����H2O2�������¿�����Ce3+ �� CeO2�ڸ÷�Ӧ��������
��2����Ȼ��Cr��Ҫ��+3�ۺ�+6�۴��ڣ�+6�۵�Cr������ϸ����ͻ�䣬�������������ƽ��仹ԭΪ+3�۵ĸ�����ɲ���ƽ�������ӷ���ʽ��
Cr2O72��+SO32��+=Cr3++SO42��+H2O
��3���ѣ�Ti������Ϊ����ʮһ���͵Ľ���������ҵ����550��ʱ���������Ȼ��ѷ�Ӧ���Ƶ��ѣ��÷�Ӧ�Ļ�ѧ����ʽ�� ��
��4��NiSO4xH2O��һ����ɫ������ˮ�ľ��壬�㷺���ڶ�������صȣ����ɵ�Ʒ����������⣬������ͭ��п������Ԫ�أ�Ϊԭ�ϻ�ã������������£� 
������Һ���м���FeS��Ϊ�˳�ȥCu2+��Zn2+�����ʣ���ȥCu2+�����ӷ���ʽΪ
�ڶ���Һ���ȼ�H2O2�ٵ�pH����pH��Ŀ���� ��
����Һ�����ʵ���Ҫ�ɷ���NiSO4 �� ��Na2CO3���˺��ټ�����ϡ�����ܽ�������NiSO4 �� ������������Ŀ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ������ͨ��O2 �� ��ˮ����NO2������ÿ��ͨ���O2����ȫ��Ӧ��������˵����ȷ���ǣ� �� 
A.���Թ�����Һ��pHֵ���ٱ仯��˵��NO2ȫ��ת��ΪHNO3
B.���Թ����岻�Ǻ���ɫʱ��˵��NO2ȫ��ת��ΪHNO3
C.ˮ���ڵ�ˮ��Ϊϡ���ᣬ����������NO2
D.ˮ���ڵ�ˮ��ΪϡNaOH��Һ������������NO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ͷ��ụΪͬ���칹�壬���з����в��ܶԶ��߽��м�����ǣ� ��
A.���ý�����
B.��������
C.���ú������
D.���ú˴Ź�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ͬѧ������ʵ��̽��Na2CO3��NaHCO3�����ʣ��ش��������⣺
��1������ͬѧ�ֱ�ȡ1.0g Na2CO3��NaHCO3���壬���μӼ���ˮ������ʢNa2CO3���Թ��¶���������ʢNaHCO3���Թ��¶��½���ԭ���� ��
��2������ͬѧ�ֱ�ȡ0.1mol/L Na2CO3��0.1mol/LNaHCO3����Һ����0.1mol/LHCl��Һ�ζ���pH�仯����������Ĺ�ϵ��ͼ��ʾ�� 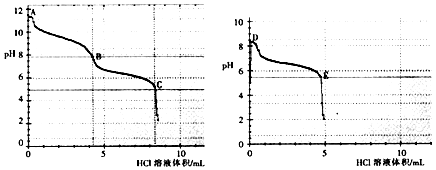
��̼���������ᷴӦpH������ͻ�䣬�ﵽ���η�Ӧ�յ㣬�ֱ�������A��B��C��D��E����
��B�����Ҫ���������û�ѧʽ��ʾ����
��B��������ڡ���С�ڡ��� D���pH����Ҫԭ���� ��
��3������ͬѧԤ��NaHCO3�����ԣ�������Һ����þ�ۣ����������ݺͳ������ɣ�д����ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������300������ӣ��������ں������Ļ������ǣ�����
A. ֬��B. ����C. ˮD. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�ȱ�����������ԣ�����ʾ����������Ե���
A. CuO+2HNO3=Cu��NO3��2+H2O B. FeO+4HNO3=Fe��NO3��3+2H2O+NO2��
C. C+4HNO3=CO2��+2H2O+4NO2�� D. NH3+HNO3=NH4NO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڼ����Ԫ�صı�����ȷ����(����)
A. �������ͬ�����н�������ǿ��Ԫ��B. �������µ��ʽ���������
C. Li��Na��K���ʾ�Ӧ������ú����D. Li��Na��Kȼ�վ����ɹ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com