
【题目】已知:4NH3(g)+5O2(g)═4NO(g)+6H2O(g),△H=﹣1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是( )
A.
B.
C.
D.
【答案】C
【解析】解:A、该反应是一个反应前后气体体积增大的放热反应,升高温度,平衡向逆反应方向移动,导致一氧化氮的含量减少,故A正确.
B、该反应是一个反应前后气体体积增大的放热反应,增大压强平衡向逆反应方向移动,导致一氧化氮的含量减少,故B正确.
C、该反应是一个反应前后气体体积增大的放热反应,升高温度,平衡向逆反应方向移动,导致一氧化氮的含量减少,故C错误.
D、催化剂能改变化学反应速率但不影响化学平衡,正催化剂能加快反应速率缩短反应到达平衡的时间,故D正确.
故选:C.
由4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=﹣1025kJ/mol知,该反应是一个反应前后气体体积增大的放热反应,升高温度,化学平衡向吸热方向移动,增大压强平衡向气体体积减小的方向移动,催化剂能改变化学反应速率但不影响化学平衡.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS及少量的Fe3O4 . 某同学用15.0g该废催化剂为原料,回收锌和铜.采用的实验方案如下,回答下列问题: 
已知:ZnS与稀硫酸反应,且化合价不变; CuS既不溶解于稀硫酸,也不与稀硫酸反应
(1)在下列装置中,第一次浸出反应装置最合理的(填标号). 
(2)滤液1中含有Fe2+ , 选用提供的试剂进行检验,检验方法如下: .
(提供的试剂:稀盐酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水)
(3)本实验要用到抽滤,设所用的洗涤剂为X,抽滤洗涤沉淀的操作 .
(4)写出第二次浸出的化学反应方程式 , 向盛有滤渣1的反应器中加H2SO4和H2O2溶液,应先加 .
(5)滤渣2的主要成分是 . 浓缩、结晶得到硫酸锌晶体的主要仪器名称是 .
(6)某同学在实验完成之后,得到1.50g CuSO45H2O,则铜的回收率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法与“节能减排”不相符的是( )
A.为推广氢能的使用,工业上可采用电解水法制取大量氢气
B.将石油裂化、裂解,综合利用石油资源
C.有节制地开采煤、石油、天然气等矿物资源
D.倡导“绿色化学”理念,逐步实现化工企业零排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己; 丁溶液为短周期元素中最高价氧化物对应水化物中碱性最强的物质.下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.Y元素在周期表中的位置为第三周期第ⅣA族
C.1mol甲与足量的乙完全反应共转移了1mol电子
D.甲、乙、丙、丁、戊、己中含有的共价键的物质只有乙、丙、己
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应的过程都是旧键断裂、新键形成的过程.对于反应:H2+I2=2HI,已知断开1molH﹣H键、1molI﹣I键分别需要吸收的能量是436kJ和151kJ,形成1molH﹣I键需要放出的能量是299kJ.
(1)1molH2和1molI2充分反应,反应物断键吸收的总能量是kJ,生成物成键放出的总能量为kJ,该反应属于(填“放热反应”或“吸热反应”).
(2)如图两个图像中,能够正确反映该反应能量变化的图像是(填“A”或“B”). 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应N2(g)+3H2(g)═2NH3(g),下列化学反应速率的表示中,所表示的反应速率最快的是( )
A.v(N2)=0.40 molL﹣1s﹣1
B.v(H2)=0.80 molL﹣1s﹣1
C.v(H2)=0.60 molL﹣1s﹣1
D.v(NH3)=1.2 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及氮的化合物在化工研究中是一门重要的课题.
(1)某无机化合物A的相对分子质量为184.在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液pH<7.将18.4gA隔绝空气加热可得到12.8gB和气体单质C.请回答:
写出SCl2与氨反应的化学方程式 .
(2)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJmol﹣1
2C(s)+O2(g)=2CO(g)△H=﹣221.0kJmol﹣1
C(s)+O2(g)=CO2(g)△H=﹣393.5kJmol﹣1
(I)汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),简述该设想能否实现的依据: .
(II)汽车尾气转化器中发生的反应:2NO(g)+2CO(g)N2(g)+2CO2(g)△H= .
(III)有容积相同的甲、乙两个密闭容器,甲充入等量的NO和CO气体,乙充入NO气体.
以Ag﹣ZSM﹣5为催化剂,分别在不同温度下同时发生反应,测得相同时间内NO的转化率,绘得图象如图1.
分析图象回答:曲线②NO转化率随温度升高而增大的原因 . 在图2中画出反应2NO(g)+2CO(g)N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图 .
(V)已知常温下HNO2的电离常数K=4.6×10﹣4 , 求0.01molL﹣1的HNO2溶液中c(H+)=molL﹣1 . ( ![]() =2.14)
=2.14)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: 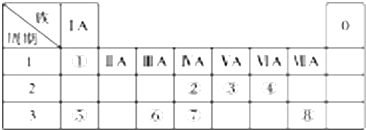
(1)地壳中含量最高的金属元素⑥在周期表中的位置是 .
(2)⑧形成的单质与水反应的离子方程式为 .
(3)②⑦的非金属性强弱可通过比较这两种元素(填编号) a.原子的得电子的能力 b.含氧酸的酸性
c.气态氢化物的稳定性 d.单质的熔沸点
(4)写出一种由④⑤⑧元素形成的既含有离子键又含有共价键的物质的电子式 .
(5)元素⑤与⑧形成的化合物属于(填“离子化合物”、“共价化合物”),用电子式表示该化合物的形成过程: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在11.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成21.4g沉淀,则下列表示X组成的选项中合理的是( )
A.0.3mol NO2
B.0.3mol NO、0.1mol NO2
C.0.6mol NO
D.0.3mol NO2、0.1mol NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com