
【题目】重铬酸钾是一种重要的化工原料,工业上由铬铁矿(主要成分为FeO·Cr2O3、SiO2等)制备,制备流程如图所示:
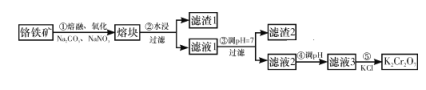
已知:
Ⅰ.步骤①的主要反应为2FeO·Cr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
Ⅱ.2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
下列说法正确的是( )
A. 步骤①熔融、氧化可以在陶瓷容器中进行
B. 步骤①中每生成44.8 L CO2共转移7 mol电子
C. 步骤④若调节滤液2的pH,使之变小,则有利于生成Cr2O72-
D. 步骤⑤生成K2Cr2O7晶体,说明该温度下K2Cr2O7的溶解度大于Na2Cr2O7
【答案】C
【解析】
铬铁矿的主要成分为FeO·Cr2O3、SiO2等,制备重铬酸钾,由制备流程可知,步骤①的主要反应为2FeO·Cr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2,Cr元素的化合价由+3价升高为+6价,Fe元素的化合价由+2价升高为+3价,N元素的化合价由+5价降低为+3价。步骤①中若使用陶瓷,二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,则使用铁坩埚,滤液2中含Na2CrO4,④中调节pH发生2CrO42-+2H+
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2,Cr元素的化合价由+3价升高为+6价,Fe元素的化合价由+2价升高为+3价,N元素的化合价由+5价降低为+3价。步骤①中若使用陶瓷,二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,则使用铁坩埚,滤液2中含Na2CrO4,④中调节pH发生2CrO42-+2H+![]() Cr2O72-+H2O,滤液3含Na2Cr2O7,由水中的溶解度:Na2Cr2O7>K 2Cr2O7,可知⑤中向Na2Cr2O7溶液中加入KCl固体后得到K 2Cr2O7,溶解度小的析出,以此来解答。
Cr2O72-+H2O,滤液3含Na2Cr2O7,由水中的溶解度:Na2Cr2O7>K 2Cr2O7,可知⑤中向Na2Cr2O7溶液中加入KCl固体后得到K 2Cr2O7,溶解度小的析出,以此来解答。
A.由上述分析可知,步骤①熔融、氧化不能使用陶瓷容器,原因是二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,故A错误;
B. 由上述分析可知步骤①的主要反应为2FeO·Cr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2,Cr元素的化合价由+3价升高为+6价,Fe元素的化合价由+2价升高为+3价,N元素的化合价由+5价降低为+3价,每生成2molCO2转移7mol电子,但没指明标况,故无法计算CO2的物质的量,故B错误;
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2,Cr元素的化合价由+3价升高为+6价,Fe元素的化合价由+2价升高为+3价,N元素的化合价由+5价降低为+3价,每生成2molCO2转移7mol电子,但没指明标况,故无法计算CO2的物质的量,故B错误;
C. 步骤④若调节滤液2的pH,发生2CrO42-+2H+![]() Cr2O72-+H2O,pH变小,平衡正向移动,则有利于生成Cr2O72-,故C正确;
Cr2O72-+H2O,pH变小,平衡正向移动,则有利于生成Cr2O72-,故C正确;
D. 向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体,说明步骤⑤发生Na 2Cr2O7+2KCl= K 2Cr2O7↓+2NaCl,说明该温度下K2Cr2O7的溶解度小于Na2Cr2O7,故D错误。
故答案选C。


科目:高中化学 来源: 题型:
【题目】E是某药物中间体,其合成路线如图:

已知:![]() ;
;
![]() 、Y、C在核磁共振氢谱上都只有一个峰。
、Y、C在核磁共振氢谱上都只有一个峰。
请回答下列问题:
(1)![]() 、
、![]() 的反应类型分别为______、______。
的反应类型分别为______、______。
(2)![]() 生成Z的化学方程式为______。
生成Z的化学方程式为______。
(3)![]() 中所含的官能团名称是______。
中所含的官能团名称是______。
(4)![]() 的化学方程式为______。
的化学方程式为______。
(5)![]() 是A的同系物,在F的同分异构体中,属于烯烃与水的加成产物的有______种
是A的同系物,在F的同分异构体中,属于烯烃与水的加成产物的有______种![]() 不考虑立体结构
不考虑立体结构![]() ,其中核磁共振氢谱有四个峰,且峰面积之比为1:2:3:6的是______
,其中核磁共振氢谱有四个峰,且峰面积之比为1:2:3:6的是______![]() 填结构简式
填结构简式![]() 。
。
(6)设计以B为原料制备草酸![]()
![]() 的合成路线:______。
的合成路线:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质一定属于同系物的是( )
①![]() ;②
;②![]() ;③
;③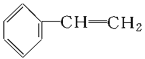 ;④C2H4;⑤CH2=CH-CH=CH2;⑥C3H6;⑦
;④C2H4;⑤CH2=CH-CH=CH2;⑥C3H6;⑦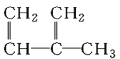 ;⑧
;⑧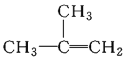
A.④和⑧B.①②和③C.⑦和⑧D.④⑥和⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:

下列说法错误的是:( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X + 3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.增大压强使平衡向生成Z的方向移动,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeOCr2O3,还含有硅、铝等杂质。制备流程如图所示:
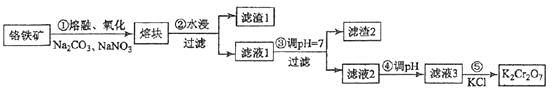
回答下列问题:
⑴步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3![]() Na2CrO4 + Fe2O3 + CO2+ NaNO2
Na2CrO4 + Fe2O3 + CO2+ NaNO2
上述反应配平后FeOCr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________(可用化学方程式表示)。
⑵步骤④调滤液2的pH使之变_________(填“大”或“小”),原因是_________(用离子方程式表示)。
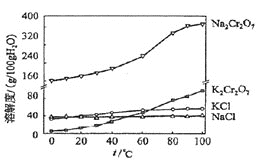
⑶有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到10℃得到的K2Cr2O7固体产品最多,步骤⑤的反应类型是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O设计的电池装置如图所示,该装置既能有效消除氮氧化物的排放减轻环境污染,又能充分利用化学能。下列说法正确的是( )

A.电池工作时,OH—从左向右迁移
B.电极A上发生氧化反应,电极A为正极
C.当有0.1molNO2被处理时,外电路中通过电子0.4mol
D.电极B的电极反应式为2NO2+8e-+8H+=N2+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑酸钠(NaSbO3)具有广泛的应用,可用作显像管、光学玻璃和各种高级玻璃的澄清剂,纺织品、塑料制品的阻燃剂,搪瓷乳白剂,制造铸件用漆的不透明填料及铁皮、钢板抗酸漆的成分。工业上用双氧水氧化法制备NaSbO33H2O的工艺流程如下:
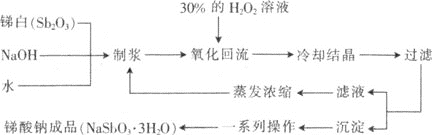
回答下列问题:
⑴NaSbO33H2O中Sb的化合价为________。
⑵先将锑白、氢氧化钠和水按一定的比例制浆,制浆过程中,搅拌、加热的目的是________。
⑶将制得的浆液加热至适当温度后,慢慢滴入30%的H2O2溶液进行氧化回流,温度不宜过高的原因是________。此过程中涉及反应如下,配平此化学方程式:
____Sb2O3 + ____H2O2 + ____NaOH + ____H2O = ____NaSbO33H2O。
⑷此流程中,可以循环利用的主要物质有________。
⑸“沉淀”主要成分为锑酸钠,流程中“一系列操作”主要包括________,产品在90~100℃下烘干,温度不宜太高的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是
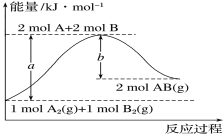
A.每生成2molAB(g)吸收bkJ热量
B.断裂1molA—A键和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.反应热ΔH=+(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原SiHCl3(沸点:31.85℃)制备纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是( )

A. 装置Ⅱ、Ⅲ中依次盛装的是浓H2SO4、冰水
B. 实验时,应先加热管式炉,再打开盛装稀硫酸的分液漏斗
C. 为鉴定制得的硅中是否含微量铁单质,需要用到的试剂为盐酸、双氧水、硫氰化钾溶液
D. 该实验中制备氢气的装置也可用于氧氧化钠稀溶液与氯化铵固体反应制备氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com