
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:
2SO2(g)+O2(g)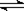 2SO3(g);
2SO3(g); kJ·mol-1。实验测得起始、平衡时的有关数据如下表:
kJ·mol-1。实验测得起始、平衡时的有关数据如下表:
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系 能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是
A.Q1=Q2=Q3=197 kJ。
B.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1>-197 kJ·mol-1。
C.甲、乙、丙3个容器中反应的平衡常数不相等。
D.达到平衡时,丙容器中SO2的体积分数最小。
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:选择题
常温时,将某浓度的CH3COOH溶液与pH=13的NaOH溶液等体积混合后,恰好完全反应生成盐和水(若混合体积变化忽略不计),则下列有关所得混合液的说法正确的是:
A.混合后溶液pH=7
B.所得混合溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.所得混合溶液中存在c(CH3COOH)+c(CH3COO-)=0.05 mol·L-1
D.混合后溶液中存在c(Na+)+c(H+)=c(CH3COOH)+c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
下列实验装置设计正确、且能达到目的的是

A.实验I:可用于吸收氨气,并能防止倒吸
B.实验Ⅱ:静置一段时间,小试管内有晶体析出
C.实验III:配制一定物质的量浓度的稀硫酸
D.实验Ⅳ:海水的淡化
查看答案和解析>>
科目:高中化学 来源: 题型:
已知E为淡黄色固体,推断A-F各物
质时,下列说法正确的是:
A. C为碳酸氢钠。
B. E的俗称是硫磺。
C. B的俗称是苛性钠。
D. D代表水。

查看答案和解析>>
科目:高中化学 来源: 题型:
有关下列两种溶液的说法中,正确的是
溶液①:0.2 mo1·L-1 CH3COONa溶液 溶液②:0.1 mo1·L-1H2SO4溶液
A.相同温度下,溶液中水的电离程度:溶液① < 溶液②。
B.加水稀释溶液①,溶液中 变大。
变大。
C.等体积混合溶液①和溶液②,所得溶液中c(CH3COO-) + 2c(SO42-) = c(Na+)。
D.25℃时,向溶液②中滴加溶液①至pH = 7,溶液中c(Na+) > c(SO42-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
K2Cr2O7是一种常见的强氧化剂,酸性条件下会被还原剂还原成Cr3+。
(1)Cr3+能与OH-、CN-形成配合物[Cr(OH)4]-、[Cr(CN)6]3-。
① Cr3+的电子排布式可表示为________。
② [Cr(OH)4]-的结构式为(并标出配位键)________。
③ CN-与N2互为等电子体,写出CN-的电子式:________。
(2)K2Cr2O7能将乙醇氧化为乙醛,直至乙酸。
①乙醛中碳原子的杂化方式________、________。
②乙酸的沸点是117.9 ℃,甲酸甲酯的沸点是31.5 ℃,乙酸的沸点高于甲酸甲酯的沸点的主要原因是 。
(3)一种新型阳极材料LaCrO3的晶胞如图所示,已知距离每个Cr原子最近的原子有6个,则图中________原子代表的是Cr原子

查看答案和解析>>
科目:高中化学 来源: 题型:
实验报告中,以下数据合理的是
A.用碱式滴定管量取25.03mLH2SO4溶液
B.用50mL量筒量取21.48mL稀硫酸
C.用托盘天平称取11.7gNaCl
D.用pH试纸测定HNO3溶液的pH=3.7
查看答案和解析>>
科目:高中化学 来源: 题型:
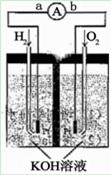
氢氧燃料电池是符合绿色化学理念的新型发电装置。
下图为电池示意图,该电池电极表面镀一层细小的铂粉,
铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中
电子流动方向为 (用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为 。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供
电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要
的储氢材料,吸氢和放氢原理如下:
2Li+H2 === 2LiH Ⅱ. LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②由LiH与H2O作用,放出的224L(标准状况)H2用作电池燃料,若能量转化率
为80%,则导线中通过电子的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是
| 物质 | X | Y | Z | W |
| 初始浓度/mol·L-1 | 0.5 | 0.6 | 0 | 0 |
| 平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.6 |
A.反应达到平衡时,X的转化率为80%
B.该反应的平衡常数表达式为K=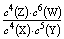
C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com