
ij�¶��£��ܱ�������X��Y��Z��W��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±�������˵���������
| ���� | X | Y | Z | W |
| ��ʼŨ��/mol��L-1 | 0.5 | 0.6 | 0 | 0 |
| ƽ��Ũ��/mol��L-1 | 0.1 | 0.1 | 0.4 | 0.6 |
A����Ӧ�ﵽƽ��ʱ��X��ת����Ϊ80%
B���÷�Ӧ��ƽ�ⳣ������ʽΪK=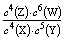
C������ѹǿ��ƽ�ⳣ�����䣬��ʹƽ��������Z�ķ����ƶ�
D���ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͬ�¶��£��ݻ���ͬ�ļס��ҡ���3�������ܱ������з������淴Ӧ��
2SO2(g)+O2(g)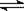 2SO3(g)��
2SO3(g)�� kJ��mol-1��ʵ������ʼ��ƽ��ʱ���й��������±���
kJ��mol-1��ʵ������ʼ��ƽ��ʱ���й��������±���
| ���� | ��ʼ�����ʵ����ʵ���/mol | �ﵽƽ��ʱ��ϵ �����ı仯 | |||
| SO2 | O2 | SO3 | Ar | ||
| �� | 2 | 1 | 0 | 0 | �ų�������Q1 |
| �� | 1.8 | 0.9 | 0.2 | 0 | �ų�������Q2 |
| �� | 1.8 | 0.9 | 0.2 | 0.1 | �ų�������Q3 |
����������ȷ����
A��Q1=Q2=Q3=197 kJ��
B���������������·�Ӧ����2molSO3(s)�ķ�Ӧ��Ϊ��H1�����H1>-197 kJ��mol-1��
C���ס��ҡ���3�������з�Ӧ��ƽ�ⳣ������ȡ�
D���ﵽƽ��ʱ����������SO2�����������С��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijʵ��С��ֻ��ȡ������������Ʒ������̨����Ȧ�����С����Ǽܡ��ձ���©������Һ©�����ƾ��ơ�����������ֽ����Ͳ��������Բ����ƿ��ֻ��������������Ʒ�����ܽ��е�ʵ�������
A������ B����ȡ C������ D������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������м������ɲ������������ʵ���Һ�����Եõ������ʵ���
A������þ B��̼������ ��C���Ȼ��� D��������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪CuSO4��Һ�ֱ���Na2CO3��Һ��Na2S��Һ�ķ�Ӧ������£�
������CuSO4+Na2CO3��Cu2++CO32��+H2O=Cu(OH)2��+CO2��
������CuSO4+Na2S�� Cu2++S2-=CuS��
���м������ʵ��ܽ�ȴ�С�ıȽ��У���ȷ����
A��CuS��Cu(OH)2��CuCO3 B��CuCO3��Cu(OH)2����uS
C��CuS��CuCO3��Cu(OH)2 D��Cu(OH)2����uCO3��CuS
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ�������£���������������������·�Ӧ��
2SO2��g��+O2 ��g��⇌2SO3��g������H��0��
��1��д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK=
��2�������¶ȣ��÷�ӦKֵ ����
����������ת���� ����
����ѧ��Ӧ���� ��С
 �����Ͼ�������С�䣩��
�����Ͼ�������С�䣩��
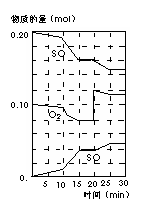
��3��600��ʱ����һ�ܱ������У������������������ϣ���Ӧ������SO2��O2��SO3���ʵ����仯��ͼ����Ӧ����ƽ��״̬��ʱ���� ��
��4����ͼ�жϣ���Ӧ������20minʱ�����߷����仯��ԭ����
������������Ũ��
�������ֱ����
��5��10min��15min�����߱仯��ԭ������� ab
����д��ţ���
a�����˴��� b����С�������
c�������¶� d������SO3�����ʵ�����
��6����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬���ǣ� ��
a�� v��SO3����2v��O2�� b��������ѹǿ���ֲ���
c��v�棨SO2��=2v����O2�� d���������������ʵ��ܶȱ��ֲ���
��7��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ����ǣ� ��
a����ʱ�����SO3���� b���ʵ������¶�
c������O2��Ũ�� d��ѡ���Ч�Ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�йذ���ӵ�����(NA)������˵������ȷ���ǣ�������
A��1 mol SiO2�����У�����2NA��Si��O���ۼ�
B�������£�4.4 g CO2��N2O������������е�ԭ����Ϊ0.3 NA
C��0.2 mol Cl2�ܽ��ڵ������ˮ�У�ת�Ƶ�����Ϊ0.2NA
D����״���£�11.2 L ���Ȼ�̼����������Ϊ0.5 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ���¶��£�������X������Y��0.16 mol����10 L�����ܱ������У�������ӦX(g)��Y(g) 2Z(g) ��H<0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
2Z(g) ��H<0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
����˵����ȷ����(����)
A����Ӧǰ2 min��ƽ������v (Z)��2.0��10��3 mol/(L��min)
B�������������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv(��)>v(��)��
C�����¶��´˷�Ӧ��ƽ�ⳣ��K��1.44
D�������������䣬�ٳ���0.2 mol Z��ƽ��ʱX�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���б�ʾ��Ӧ��ѧ��Ӧ����̵����ӷ���ʽ��ȷ����
A��ͭƬ������������Һ�У�Cu��Ag����Cu2����Ag
B��̼������������NaOH��Һ��ӦCa2����2HCO3����2OH����CaCO3����2H2O��CO32��
C����ʯī���缫���AlCl3��Һ��2Cl����2H2O Cl2����H2����2OH��
Cl2����H2����2OH��
D��������������Һ�����ԣ�NaHSO3��Na��+H��+ SO32��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com