
下列表示对应化学反应或过程的离子方程式正确的是
A.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
B.碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C.用石墨作电极电解AlCl3溶液:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.亚硫酸氢钠溶液显酸性:NaHSO3=Na++H++ SO32-
科目:高中化学 来源: 题型:
某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是
| 物质 | X | Y | Z | W |
| 初始浓度/mol·L-1 | 0.5 | 0.6 | 0 | 0 |
| 平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.6 |
A.反应达到平衡时,X的转化率为80%
B.该反应的平衡常数表达式为K=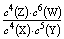
C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于SO2的叙述,正确的是
A.SO2具有氧化性,因而可以使溴水褪色
B.大气中SO2的主要来源是汽车排出的尾气
C.SO2具有漂白性,因而可以使石蕊试液褪色
D.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
在含1mol KAl(SO4)2的溶液中逐滴加入含2mol Ba(OH)2的溶液,下列有关说法中正确的是
A.先生成沉淀,后沉淀全部溶解
B.当溶液中Al3+全部沉淀出来时,沉淀的总物质的量最大
C.最后得到的沉淀是BaSO4
D.最后的沉淀为2mol BaSO4、1mol Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol/L的NaHSO4溶液:K+、Fe2+、NO3-、Cl-
B.l.0 mol·L-1 NaClO溶液:Fe2+、K+、I一、Cl-
C.甲基橙显黄色的溶液: Na+、CO32-、NO3-、SO32-
D.在c(H+)/c(OH-) = 1×1013的溶液:NH4+、Ca2+、C1-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液,再水浴加热 | 无银镜生成 | 淀粉未发生水解 |
| B | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有CO32-或HCO3- |
| C | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
| D | 取久置的绿矾(FeSO4·7H2O)溶于水,加入KSCN溶液 | 溶液变为血红色 | 绿矾部分或全部被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
前段时间席卷我国大部的雾霾天气给人们的生产生活带来了极大的影响,据统计我国部分城市雾霾天占全年一半,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、金属氧化物、有机颗粒物及扬尘等。
(1)有机颗粒物的产生主要是由于不完全燃烧导致的相关热化学方程式如下:
①C(s)+O2(g)===CO2(g) ΔH1=-94kJ·mol-1;②C8H16(l)+12O2(g)=8CO2(g)+8H2O(l) ΔH2=-1124kJ·mol-1
③C8H16(l)+4O2=8C(g)+8H2O(l)ΔH3= kJ·mol-1
(2)纳米二氧化钛可光解挥发性有机污染物(VOCs),若无水蒸气存在,三氯乙烯降解反应为:C2HCl3+2O2→2CO2+HCl+Cl2,若有足够量的降解后的尾气,实验室检验产物中有氯气的简单方法是: ;通过质谱仪发现还有多种副反物,其中之一为: ,则该有机物核磁共振氢谱有 个峰。
,则该有机物核磁共振氢谱有 个峰。
已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3。
(3)在铜盐溶液中Cu2+发生水解反应的离子方程式为____,该反应的平衡常数为____;(已知:25℃时,Ksp[Cu(OH)2]=2.0×10-20mol3/L3)
(4)电解Na2HPO3溶液可得到亚磷酸,装置如右图
(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组用以下装置探究SO2的某些化学性质。

(1)装置乙的作用是 。
(2)若X为品红溶液,观察到溶液褪色,说明SO2具有 (填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
a.氧化性 b.还原性 c.漂白性
(3)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式:
 Ca2++
Ca2++ ClO-+
ClO-+ SO2+
SO2+ H2O=
H2O= ↓+
↓+ Cl-+
Cl-+ SO42-+
SO42-+ 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl。已知H2S为反应物,则另一反应物是 ( )
A.FeCl3 B.FeCl2 C.S D.HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com