
【题目】W、X、Y、Z、M、G六种元素分属三个短周期,且原子序数依次增大。W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性。请回答下列问题:
(1)Y在元素周期表中的位置为_________,上述元素的最高价氧化物对应的水化物酸性最强的是_____(写化学式),W、Y、Z、M形成的简单离子的半径大小顺序是___________________(用化学符号表示),G的离子结构示意图:_______________。
(2) Y与M的氢化物中,热稳定性更好的是____________(填化学式),原因是____________________________________________________________。
(3)Z2Y2的电子式为__________,ZW与水反应放出气体的化学方程式为_______________________________________________________________________。
(4)X2W4可作为新型燃料电池的燃料,在氧气中燃烧生成氮气和水,请利用X2W4、氧气与KOH溶液组成碱性燃料电池,写出该电池负极的电极反应式________________________,指出电解质溶液中OH-离子向________极移动。
【答案】(1) 第二周期ⅥA族 HClO4S2-> O2->Na+>H+ 
(2) H2O O的非金属性大于S(3)![]() NaH+H2O==NaOH+H2↑
NaH+H2O==NaOH+H2↑
(4)N2H4 -4e-+4OH-==N2+4H2O 负
【解析】试题分析:W、X、Y、Z、M、G六种元素分属三个短周期,原子序数依次增大,则W应为H元素,X元素的气态氢化物水溶液呈碱性,则X为N元素;Y、M同主族,可形成MY2、MY3两种分子,则M为S元素、Y为O元素,W、Z同主族,可形成离子化合物ZW,Z的原子序数小于S,应为Na元素,G原子序数大于S原子序数,则G为Cl元素;(1)Y为O元素,在元素周期表中的位置为:第二周期第VIA族;上述五种元素的最高价氧化物对应的水化物酸性最强的是HClO4; 电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故W、Y、Z、M形成的简单离子的半径大小顺序是S2-> O2->Na+>H+ ;G的离子结构示意图:
(2)O与S的氢化物中,H2O更稳定,应为O的非金属性大于S;
(3)Z2Y2的化学式为Na2O2,电子式为![]() ,ZW为NaH,与水反应放出气体的化学方程式为:NaH+H2O==NaOH+H2↑;
,ZW为NaH,与水反应放出气体的化学方程式为:NaH+H2O==NaOH+H2↑;
(4)肼﹣空气燃料电池是一种碱性燃料电池工作时,负极上肼失电子发生氧化反应,电极反应式为N2H4﹣4e﹣+4OH﹣═N2+4H2O,正极上发生得电子的还原反应,即2H2O+O2+4e﹣═4OH﹣,N2H4 -4e-+4OH-==N2+4H2O 。


科目:高中化学 来源: 题型:
【题目】苯胺为无色液体,还原性强,易被氧化;有碱性,与酸反应生成盐。常用硝基苯与H2制备:![]() 。
。
其部分装置及有关数据如下: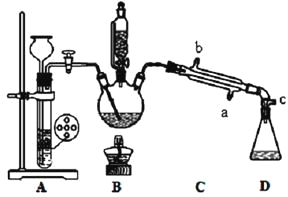
沸点/℃ | 密度g/mL | 溶解性 | |
硝基苯 | 210.9 | 1.20 | 不溶于水,易溶于乙醇、乙醚 |
苯胺 | 184.4 | 1.02 | 微溶于水,易溶于乙醇、乙醚 |
乙醚 | 34.6 | 0.71 | 不溶于水,易溶于硝基苯、苯胺 |
实验步骤:
①检查装置的气密性,连接好C处冷凝装置的冷水。
②先向三颈烧瓶中加入沸石及硝基苯,再取下恒压分液漏斗,换上温度计。
③打开装置A、B间活塞,通入H2一段时间。
④点燃B处的酒精灯,加热,使温度维持在140℃进行反应。
⑤反应结束后,关闭装置A、B间活塞,加入生石灰。
⑥调整好温度计的位置,继续加热,收集182~186℃馏分,得到较纯苯胺。
回答下列问题:
(1)步骤⑥中温度计水银球的位置在__________。
(2)下列关于实验的叙述中,错误的是__________。
A.冷凝管的冷水应该从b进从a出
B.实验开始酎,温度计水银球应插入反应液中,便于控制反应液的温度
C.装置A中应使用锌粉,有利于加快生成H2的速率
D.加入沸石的目的是防止暴沸
(3)若实验中步骤③和④的顺序颠倒,则实验中可能产生的后果是_____________。
(4)蒸馏前,步骤⑤中加入生石灰的作用是____________________。
(5)有学生质疑反应完成后,直接蒸馏得到苯胺的纯度不高,提出以下流程:

苯胺在酸性条件下生成盐酸苯胺被水萃取,在碱性溶液中又被放有机溶剂反萃取,这种萃取——反萃取法简称反萃。实验中反萃的作用是__________;在分液漏斗中进行萃取分液时,应注意不时放气,其目的是____________________。
(6)苯胺还原性强,易被氧化,请配平下列化学方程式的化学计量数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2015 年9 月3 日胜利日大阅兵中,八一飞行表演队首次使用高沸点的彩色拉烟剂,进行了绚丽的拉烟飞行.其原理是用氮气将拉烟剂带入飞机燃料燃烧后喷出的高温气体中,其中的水蒸气与气化后的彩色拉烟剂遇冷凝结形成“彩雾”.下列说法不正确的是

A.“彩雾”是一种混合物
B.上述过程中有物理变化
C.燃料燃烧产生的热量促使拉烟剂气化
D.“彩雾”的形成与焰色反应的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂电池应用很广,某种锂离子电池,其正极材料可再生利用。其正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-=LixC6,现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
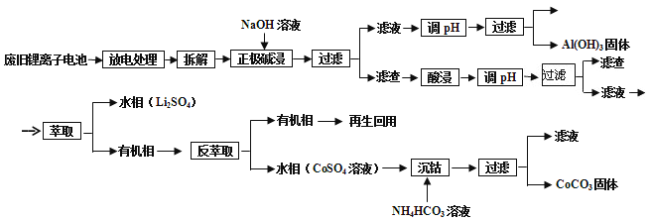
回答下列问题:
(1)写出“正极碱浸”中发生反应的化学方程式____________;
(2)“酸浸”一般在80℃下进行,写出该步骤中发生的主要氧化还原反应的化学方程式________________________;如果可用盐酸代替H2SO4和H2O2的混合溶液,可能发生反应的离子方程式___________________________;
(3)写出“沉钴”过程中发生反应的化学方程式______________________________;
(4)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出充电时正极的电极反应_____________________________________;
(5)在整个回收工艺中,可回收到的金属化合物有____________(填化学式);
(6)最近美国和韩国的科学家合作研究出新型锂—空气电池,他们的锂—空气电池在放电过程中产生稳定的晶状超氧化锂(LiO2),超氧化锂可以很容易地分解成锂和氧,从而具有更高的效率和更长的循环寿命。请写出该电池正极的电极反应 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计了如图所示实验,以确认某混合气体中含有C2H4和SO2。

混合气体
所需试剂有
A.品红溶液 B.NaOH溶液
C.浓H2SO4 D.酸性高锰酸钾溶液
试回答下列问题:
(1)写出图中①、②、③、④装置可盛放的试剂(将上述有关试剂的序号填入空格内):
①________,②________,③________,④________。
(2)使用装置②的目的是_____________________________________________________。
(3)写出SO2与酸性高锰酸钾反应的离子方程式:
____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇、甲醚是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) △H=-256.1kJmol-1。
CH3CH2OH(g)+H2O(g) △H=-256.1kJmol-1。
已知:H2O(l)=H2O(g)△ H=+44kJmol-1 CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJmol-1
CO2(g)+H2(g) △H=-41.2kJmol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) △H=__________________kJmol-1
CH3CH2OH(g)+3H2O(l) △H=__________________kJmol-1
(2)把2molH2和1molCO通入1L的反应器中,一定条件下发生反应:
2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示。
CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示。
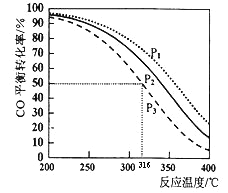
①以下能说明2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)达平衡状态的是___________
CH3OCH3(g)+H2O(g)达平衡状态的是___________
A.密度不再变化
B.CH3CH2OH蒸汽的体积分数不再变化
C.c(CO)/c(H2)不变
D.[c(CH3OCH3)c(H2O)]/[c(CO)c(H2)]不变
②图中的压强大小为: ,△H___________0(填“>”“<”或“=”),若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时反应的v(正)______v(逆)(填“>”“<”或“=”)。
③P3和316℃时反应的平衡常数________________
(3)汽车使用乙醇汽油并不能更加有效减少NOx的排放,气缸中生成NO的反应为:
N2(g)+O2(g)![]() 2NO(g) △H>0
2NO(g) △H>0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是_________________
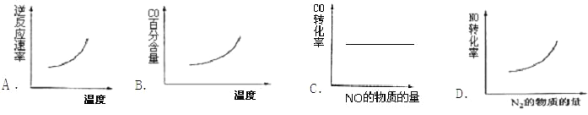
②汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H=-746.8kJ/mol-1。在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是_______
N2(g)+2CO2(g)△H=-746.8kJ/mol-1。在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是_______
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池负极的电极反应式为__________________。用该电池为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O充电,充电一段时间后(假定两极充电前质量相等),测得两极质量差为6.4g时,通过电路电子的物质的量为__________________。
2PbSO4+2H2O充电,充电一段时间后(假定两极充电前质量相等),测得两极质量差为6.4g时,通过电路电子的物质的量为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积不变的密闭容器中,发生反应:2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
(1)当n(NO):n(O2)=4:1时,O2的转化率随时间的变化关系如下图所示。

①A点的逆反应速率v逆(O2)_____B点的正反应速率v正(O2)(填“大于”、“小于”或“等于” )。
②NO的平衡转化率为______;当达到B点后往容器中再以4:1 加入些NO和 O2,当达到新平衡时,则NO的百分含量 B点NO的百分含量(填“大于”、“小于”或“等于” )。
③到达B点后,下列关系正确的是( )
A.容器内气体颜色不再变化 B.v正(NO)=2 v正(O2)
C.气体平均摩尔质量在此条件下达到最大 D.容器内气体密度不再变化
(2)在下图1和图2中出现的所有物质都为气体,分析图1和图2,可推测:4NO(g)+3O2(g)=2N2O5(g) △H= 。
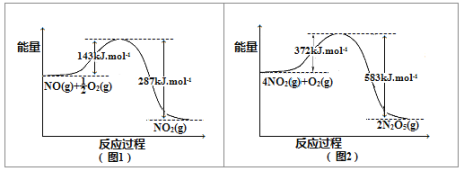

(3)降低温度,NO2(g)将转化为N2O4(g),以N2O4、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,Y为 ,有关石墨I电极反应式可表示为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1中的△H1>△H2
B. 对于可逆反应A(s)+3B(g)![]() 2C(g) △H>0,压强对平衡常数K的影响符合图2
2C(g) △H>0,压强对平衡常数K的影响符合图2
C. 图3表示充满NO2气体的试管,倒置于水槽中,向其中缓慢通入氧气直至试管中全部充满水,假设溶质不扩散,溶质的物质的量浓度与通入氧气的体积关系
D. 由图4可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g),K1 △H1<0 (Ⅰ)
NaNO3(s)+ClNO(g),K1 △H1<0 (Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g),K2 △H2<0 (Ⅱ)
2ClNO(g),K2 △H2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10﹣3molL﹣1min﹣1,则平衡后n(Cl2)= mol,NO的转化率α1= .其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”“不变”)。
(3)实验室可用NaOH溶液吸收NO2,反应2NO2+2NaOH═NaNO3+NaNO2+H2O,含0.2mol NaOH水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1molL﹣1的CH3COONa溶液,则两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1)可使溶液A和溶液B的pH值相等的方法是 。
a、向溶液A中加适量水 b、向溶液A中加适量NaOH
c、向溶液B中加适量水 d、向溶液B中加适量NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com