
【题目】A(C2H2)是基本有机化工原料。由A制备聚乙烯醇缩丁醛和顺式异戊二烯的合成路线(部分反应条件略去)如下所示:

回答下列问题:
(1)A的名称是_______,B含有的官能团是_______________。
(2)①的反应类型是____________,⑦的反应类型是________________。
(3)C和D的结构简式分别为______________、_________________。
(4)异戊二烯分子中最多有________个原子共平面,顺式聚异戊二烯的结构简式为___________。
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体__________(填结构简式)。
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线___________________。
【答案】乙炔 碳碳双键和酯基 加成反应 消去反应 ![]() CH3CH2CH2CHO 11
CH3CH2CH2CHO 11 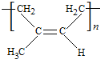 CH3CH(CH3)-C≡CH、CH3CH2CH2C≡CH、CH3CH2C≡CCH3
CH3CH(CH3)-C≡CH、CH3CH2CH2C≡CH、CH3CH2C≡CCH3 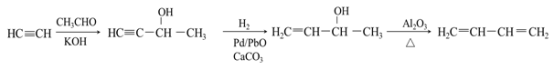
【解析】
由分子式可知A为HC≡CH,结合乙炔(C2H2)和乙酸(C2H4O2)的分子式可知B(C4H6O2)为A与乙酸发生加成反应所得,生成B为CH2=CHOOCCH3,发生加聚反应生成![]() ,水解生成C为
,水解生成C为![]() ,由聚乙烯醇缩丁醛可知D为CH3CH2CH2CHO,HC≡CH与丙酮在KOH条件下发生加成反应生成
,由聚乙烯醇缩丁醛可知D为CH3CH2CH2CHO,HC≡CH与丙酮在KOH条件下发生加成反应生成![]() ,与氢气发生加成反应生成
,与氢气发生加成反应生成![]() ,在氧化铝的作用下发生消去反应生成异戊二烯,异戊二烯在催化作用下发生加聚反应生成
,在氧化铝的作用下发生消去反应生成异戊二烯,异戊二烯在催化作用下发生加聚反应生成 ,以此解答该题。
,以此解答该题。
(1)A的名称是乙炔,B为CH2=CHOOCCH3,B含有的官能团是碳碳双键和酯基。
(2)根据以上分析可知反应①是加成反应,反应⑦是消去反应。
(3)根据以上分析可知C为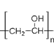 ,D为CH3CH2CH2CHO。
,D为CH3CH2CH2CHO。
(4)异戊二烯结构简式为CH2=C(CH3)-CH=CH2,分子中含有2个C=C键,与C=C键直接相连的原子在同一个平面上,甲基有1个H原子与C=C键也可能在同一个平面上,则共有11个原子共平面,如图所示: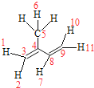 。聚异戊二烯是1,4—加成反应,四碳链中间有一个双键,按照顺反异构的知识写出顺式结构为
。聚异戊二烯是1,4—加成反应,四碳链中间有一个双键,按照顺反异构的知识写出顺式结构为 。
。
(5)与A具有相同官能团的异戊二烯的所有同分异构体应含有C≡C键,可能的结构简式有CH3CH(CH3)-C≡CH、CH3CH2CH2C≡CH、CH3CH2C≡CCH3等。
(6)乙炔与乙醛发生加成反应生成HC≡CCHOHCH3,然后与氢气发生加成反应生成H2C=CHCHOHCH3,在氧化铝作用下加热发生消去反应生成CH2=CHCH=CH2,该题最好的方法是使用逆推法,合成路线为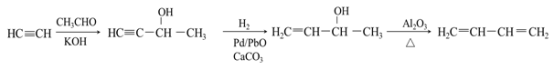 。
。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】有人设计了如图所示实验装置,目的是做钠与水反应实验,并验证①钠的物理性质;②钠与水反应的产物是什么。

(1)当进行适当操作时还需要的仪器有________。
(2)如何进行操作?__________。
(3)实验现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1的HA溶液中c(OH-)/c(H+)=1×10-8,下列叙述中正确的是( )
A. 0.01 mol·L-1HA的溶液中c(H+)=1×10-4mol·L-1
B. pH=3的HA溶液与pH=11的NaOH溶液等体积混合后所得溶液中c(Na+)>c(A-)>c(OH-)>c(H+)
C. 浓度均为0.1 mol·L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则c(OH-)-c(H+)<c(HA)-c(A-)
D. pH=3的HA溶液与pH=11的NaOH溶液按体积比1:10混合后所得溶液中c(OH-)+c(A-)=c(H+)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习小组进行CH4的制备及性质探究实验。根据反应:CH3COONa(固体)+NaOH(固体)→ Na2CO3+CH4↑制备气体。
(1)用CH4气体分别进行下列实验:
①通入酸性KMnO4溶液,现象是______________________________。
②在无色玻璃集气瓶中与C12混合后光照,现象是___________________________。
(2)为了验证CH4是否具有还原性,某小组设计了如下实验:

①当玻璃管中的氧化铜由黑色变为红色时,说明CH4具有还原性。你认为这一结论是否正确?__________(填“正确”或“不正确”),理由是______________________________。
②实验过程中还观察到无水CuSO4逐渐变蓝,澄清石灰水出现浑浊现象,则CH4与CuO反应的化学方程式为______________________________。
(3)研究小组将CH4通入溴水时,发现溴水逐渐褪色,你认为原因可能是______________。请设计一个实验方案证明你的结论(用文字表示,不必画实验装置图)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:__________与盐酸反应最剧烈,__________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_______,________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。

(3)仪器A的名称为________,干燥管D的作用是_____________________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_________________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】150℃时,11.6g CO2和H2O的混合气体与足量的Na2O2充分反应后,固体物质的质量增加了3.6g,则原混合气体中CO2与H2O的物质的量之比是( )
A.1:4B.3:11C.1:11D.21:22
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为:![]() ,该反应一定条件下可自发进行。若反应在恒容密闭容器中进行,下列由该反应作出的判断(有关图像)错误的是( )
,该反应一定条件下可自发进行。若反应在恒容密闭容器中进行,下列由该反应作出的判断(有关图像)错误的是( )
A.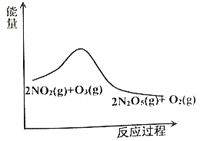 B.
B.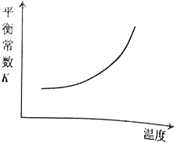
C.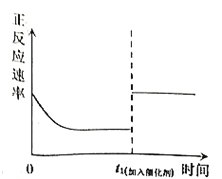 D.
D.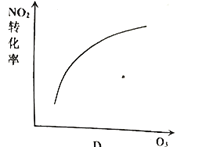
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com