
【题目】元素A,B,C,D分别位于三个不同短周期,且原子序数依次增大.只有D为金属元素,它们可形成x、y、z、w四种常见的二元化合物及p、q两种常见三元化合物,它们之间存在如下转化关系;①x ![]() p
p ![]() q+z,②y
q+z,②y ![]() p+O2↑,其中z为液体、w为气体,其余均为固体.下列有关说法正确的是( )
p+O2↑,其中z为液体、w为气体,其余均为固体.下列有关说法正确的是( )
A.原子半径大小顺序:D>C>B>A
B.y、p 中均只含有离子键
C.B,D两元素最高价氧化物对应水化物分别为强酸、强碱
D.p能抑制水的电离而q能促进水的电离
【答案】D
【解析】解:四种元素分别位于三个不同短周期且A的原子序数最小,则A为H元素,由两种短周期元素形成的二元化合物发生反应有氧气生成和z为常见液体可知z为H2O,y为Na2O2 , 根据反应①可知x为Na2O,p为NaOH,w为CO2或SO2 , q为Na2CO3或Na2SO3 , 结合原子序数关系及D为金属可知B为C元素,C为O元素,D为Na元素,则w为CO2 , q为Na2CO3 , A.B为C元素,C为O元素,同周期元素从左到右原子半径逐渐减小,原子半径B>C,故A错误;
B.y为Na2O2 , p为NaOH,含有离子键和共价键,故B错误;
C.知B为C元素,对应的最高价氧化物的水化物为碳酸,属于弱酸,故C错误;
D.q为Na2CO3 , 水解呈碱性,促进水的电离,加入氢氧化钠可抑制碳酸钠的水解,故D正确.
故选D.


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分. 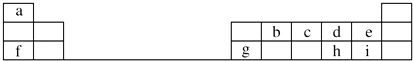
回答下列问题:
(1)元素b在元素周期表中的位置是 .
(2)元素a与c形成的4核10电子分子的化学式为 , 其水溶液呈性.
(3)元素e的负一价离子的结构示意图为 , 元素g的简单离子的结构示意图为 , 二者的离子半径大小顺序为 .
(4)元素i的气态氢化物比元素e的气态氢化物(填“稳定”或“不稳定”).
(5)元素i的单质溶于元素f的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的电子式为 , 该化合物中所含的化学键类型为 .
(6)元素d与h形成的化合物的化学式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 红磷、白磷属于同位素B. H2、D2属于同素异形体
C. 4019K、4020Ca互为同位素D. H、D、T互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列叙述,写出元素名称,并写出核外电子排布式.
(1)A元素原子核外M层电子数是L层电子数的一半: .
(2)B元素原子的最外层电子数是次外层电子数的1.5倍: .
(3)C元素的单质在常温下可与水剧烈反应,产生的气体能使带火星的木条复燃: .
(4)D元素的次外层电子数是最外层电子数的 ![]() : .
: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用作软质隐形眼镜材料的聚合物E是: 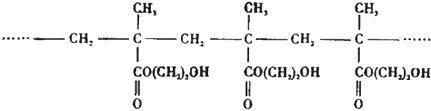
一种合成聚合物 E的路线如下: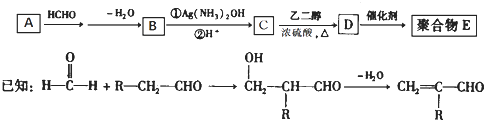
回答下列问题:
(1)A能与新制Cu(OH)2悬浊液反应产生砖红色沉淀,A的结构简式是;
(2)D中含有的官能团名称为:;
(3)D→E的反应类型是反应;
(4)C有多种同分异构体.属于酯且含有碳碳双键的同分异构体共有种(不考虑顺反异构),写出其中核磁共振氢谱峰面积之比为1:1:1:3的同分异构体的结构简式:
(5)写出由乙烯合成乙二醇的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类的说法正确的是
A. 二氧化碳、二氧化硅、一氧化碳均为酸性氧化物
B. 雾、稀豆浆、氯化铁溶液均为胶体
C. 烧碱、冰醋酸、稀硫酸均属于电解质
D. 分子中含有两个氢原子的酸不一定是二元酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“保护环境”是我国的基本国策。下列做法不应该提倡的是
A. 采取低碳、节俭的生活方式
B. 按照规定对生活废弃物进行分类放置
C. 深入农村和社区宣传环保知识
D. 经常使用一次性筷子、纸杯、塑料袋等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷是制备高纯度磷酸、烟幕弹、燃烧弹等的重要原料,工业上制备白磷的原理之一为4Ca5 (PO4)3F+21Si02+30C3P4+20GaSiO3+30CO↑+SiF4 , 回答相关问题:
(1)基态磷原子的价层电子排布图为 , 上述反应涉及的第二周期元素中第一电离能由大到小的顺序为(用元素符号表示).
(2)上述物质中,中心原子杂化轨道类型为sp3的分子有 , SiF4分子构型为 . 若不考虑C的晶体类型,则上述反应过程消失的晶体类型为 .
(3)碳、硅同一主族,CF4沸点比SiF4低的原因是;碳能形成π键而硅难形成π键的主要原因是 .
(4)图1为硫、磷元素形成的一种分子,分子中每个原子最外层均达到8电子稳定结构,该化合物的分子式为 , 若其晶体中分子的堆积方式与干冰相同,则晶体中每个分子的配位数是 . 
(5)碳、硅两种元素形成的一种高硬度化合物的晶胞如图2所示,若该化合物的密度为ρgcm3 , 晶胞参数为a pm,则阿伏伽德罗常数为mol﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)Ⅰ.在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(含有Fe2+、Fe3+、Cu2+)处理和资源回收很有意义.分析下面处理方案,回答下列问题: 
试剂2是 , 固体B是 , 通往的气体C是 . (填化学式).
(2)写出加入试剂1发生反应的离子方程式:、 .
(3)Ⅱ.综合利用海水可以制备食盐、纯碱、金属镁等物质,其流程如下图所示: 
反应①﹣⑤中,属于氧化还原反应的是(填符号).
(4)写出反应②的离子方程式 .
(5)X溶液中的主要阳离子是Na+和 .
(6)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液;③;④加适量盐酸;⑤(请补全缺少的实验步骤).
(7)检验纯碱样品中是否含NaCl应选用的试剂是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com