
【题目】某化肥样品和熟石灰混合后可以闻到氨味,下列分析正确的是 ( )
A. 样品中含有NH4+ B. 样品中含有NO3-
C. 该化肥具有氮肥的功效 D. 这是磷肥
科目:高中化学 来源: 题型:
【题目】下列物质的用途描述不正确的是
A. 晶体硅可用作制作半导体材料B. 碳酸钠可用于制胃酸中和剂
C. 氧化铁可用于制作红色涂料D. 明矾可用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生如下反应:PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始物质的量 | 平衡物质的量 | 达到平衡所需时间 | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ<容器Ⅰ
C.反应到达平衡时,容器I中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl50.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2溶液发生分解反应:2H2O2=O2↑+2H2O,在其他条件都相同的情况下,下列反应温度中氧气生成速率最大的是
A.80℃B.60℃C.40℃D.20℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.
光解水的催化材料可用硝酸镍、硫脲和锐钛矿为原料,采用醇热法制得。
(1)Ni2+基态核外电子排布式为__________________。
(2)与NO3-互为等电子体的一种分子的化学式为__________________。
(3)硫脲(![]() )中C原子轨道的杂化类型为__________________;
)中C原子轨道的杂化类型为__________________;
1 mol硫脲中含有键的数目为____________mol。
钛的一种氟化物晶胞结构如右图所示,其化学式为____________。

(5)甘油(丙三醇)具有保持水分的功效,其主要原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为: 2NH3(g)+CO2(g) ![]() CO(NH2)2 (l)+H2O (l)。
CO(NH2)2 (l)+H2O (l)。
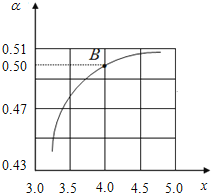
(1)T1℃时,在2L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() =x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是__________________.
=x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是__________________.
(2)当x=2,上述反应至5min时各物质的浓度不再发生变化,若起始的压强为P0KPa,测得平衡体系压强变为起始时的![]() 。反应结束后,分离得到90g尿素。
。反应结束后,分离得到90g尿素。
试计算该反应的平均速率υ(CO2)=________________,该反应的平衡常数K=___________,达到平衡后NH3的物质的量浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钍 ![]() Th的原子可发生下列放射性变化:
Th的原子可发生下列放射性变化: ![]() Th→
Th→ ![]() X+
X+ ![]() He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是( )
He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是( )
A.X的氢氧化物是一种强碱
B.X元素位于第六周期
C.X的碳酸盐难溶于水
D.X的最高化合价为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分: 
请参照元素①一⑨在周期表表中的位置,用化学用语回答下列问题:
(1)写出元素⑥在周期表中的位置是 .
(2)元素⑤、⑧、⑨的离子半径由大到小的顺序为 .
(3)元素①④⑨形成原子个数比1:1:1化合物的电子式为;写出元素⑤和⑧形成原子个数比2:1化合物的形成过程: .
(4)元素⑤和⑥最高价氧化物水化物反应的离子方程式为 .
(5)②的单质与⑧的最高价氧化物水化物浓溶液反应的化学方程式为 , 若反应中有6.02×1023个电子发生转移,则生成的气体标准状况下的体积为L.
(6)写出一个方程式,证明元素⑧的非金属性比元素⑨弱: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com