

 �Ʊ���˾ƥ�ֵĺϳ�·�ߣ�������ʾ���еĺϳ�·������ͼ��ʾ��ͬʱע����ѡ�Լ��ĺ����ԣ���ʾ����CH2=CH2
�Ʊ���˾ƥ�ֵĺϳ�·�ߣ�������ʾ���еĺϳ�·������ͼ��ʾ��ͬʱע����ѡ�Լ��ĺ����ԣ���ʾ����CH2=CH2| HBr |
| NaOH |
| ˮ/�� |
 ��B��Ӧ����
��B��Ӧ���� �����B�Ľṹ��ʽ��֪BΪ��
�����B�Ľṹ��ʽ��֪BΪ�� ������Ũ������Ũ���������·�Ӧ����A����AΪ
������Ũ������Ũ���������·�Ӧ����A����AΪ ��
�� ����ϵ�з�Ӧ���ɰ�˾ƥ�֣���˾ƥ�ֵķ���ʽ�к����������Ȼ�����ṹ��ʽΪ��
����ϵ�з�Ӧ���ɰ�˾ƥ�֣���˾ƥ�ֵķ���ʽ�к����������Ȼ�����ṹ��ʽΪ�� ���ݴ˽��1������4����
���ݴ˽��1������4���� ���κ�
���κ� �����ữ����
�����ữ���� ��
�� �������������������·�Ӧ���ɰ�˾ƥ�֣��ݴ�д���Ʊ����̣�
�������������������·�Ӧ���ɰ�˾ƥ�֣��ݴ�д���Ʊ����̣� ��B��Ӧ����
��B��Ӧ���� �����B�Ľṹ��ʽ��֪BΪ��
�����B�Ľṹ��ʽ��֪BΪ�� ������Ũ������Ũ���������·�Ӧ����A����AΪ
������Ũ������Ũ���������·�Ӧ����A����AΪ ��
�� ����ϵ�з�Ӧ���ɰ�˾ƥ�֣���˾ƥ����������ˮ���ᣬ�����ʽC9H8O4���ṹ��ʽΪ��
����ϵ�з�Ӧ���ɰ�˾ƥ�֣���˾ƥ����������ˮ���ᣬ�����ʽC9H8O4���ṹ��ʽΪ�� ��
�� ��B�Ľṹ��ʽΪ
��B�Ľṹ��ʽΪ ��
�� ��
��  ��
�� ������Ũ���ᷴӦ��������������Ӧ�Ļ�ѧ����ʽΪ��
������Ũ���ᷴӦ��������������Ӧ�Ļ�ѧ����ʽΪ��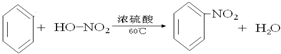 ��
�� ��
�� ��
�� ��Ӧ����
��Ӧ���� ��ȩ���ӳ������ǻ����ǻ�������ȥ��Ӧ����C=N˫�����漰�ķ�ӦΪ�ӳɷ�Ӧ����ȥ��Ӧ��
��ȩ���ӳ������ǻ����ǻ�������ȥ��Ӧ����C=N˫�����漰�ķ�ӦΪ�ӳɷ�Ӧ����ȥ��Ӧ�� ��
�� ��
�� ��
�� ��
�� �Ʊ���˾ƥ�֣��������Ƶ�������ͭ��ȩ���������Ȼ��õ�
�Ʊ���˾ƥ�֣��������Ƶ�������ͭ��ȩ���������Ȼ��õ� ��
�� �����ữ����
�����ữ���� ��
�� �������������������·�Ӧ���ɰ�˾ƥ�֣��Ʊ�����Ϊ��
�������������������·�Ӧ���ɰ�˾ƥ�֣��Ʊ�����Ϊ�� ��
�� ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��NH4Cl��Һ�У�c��Cl-��+c��H+��=c��NH4+��+c��OH-��+2c��NH3��H2O�� |
| B��Na2CO3��NaHCO3��Һ�У�c��Na+��+c��H+��=c��OH-��+c��HCO3-��+c��CO32-�� |
| C�������ʵ�����һԪ����HX�������KX�Ļ����Һ�У�2c��K+��=c��X-��+c��HX��+c��H+�� |
| D��pH=3��һԪ��HX��pH=11��һԪ��MOH�������ϣ�c��M+��=c��X-����c��H+��=c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| c(Cl-) |
| c(ClO-) |
A����ij�¶��£���Ӧ��
| ||||||||
B���μӷ�Ӧ�ı���ԭ������Ϊ
| ||||||||
C���ı��¶ȣ���Ӧ��ת�Ƶ��ӵ����ʵ���ne�ķ�Χ��
| ||||||||
D���ı��¶ȣ�������KClO3��������۲���Ϊ
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��s�ܼ�����������С��p�ܼ������� |
| B��2s�ĵ����Ʊ�1s�ĵ����ƴ�˵��2s�ĵ������еĵ��ӱ�1s�Ķ� |
| C���������Ų���ͬһ�ܼ��IJ�ͬ���ʱ������������ռ��1�������Ȼ����ռ������ԭ�ӹ�� |
| D��nf�ܼ�����������14������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ba2+ |
| B��OH- |
| C��Cu2+ |
| D��Al3+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��Ӧʱ��/min | n[CO]/mol | n[H2O]/mol |
| 0 | 1.8 | 0.9 |
| 2 | 1.2 | x |
| 4 | y | 0.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��HCOOC2H5 |
| B��CH3COOCH3 |
| C��HCOOCH3 |
| D��CH3COOC2H5 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com