
| c(Cl-) |
| c(ClO-) |
A、若某温度下,反应后
| ||||||||
B、参加反应的被还原的氯气为
| ||||||||
C、改变温度,反应中转移电子的物质的量ne的范围:
| ||||||||
D、改变温度,产物中KClO3的最大理论产量为
|
| C(Cl-) |
| C(ClO-) |
| C(Cl-) |
| C(ClO-) |
| C(Cl-) |
| C(ClO3-) |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 6 |
| 1 |
| 6 |
| 1 |
| 6 |
| 5 |
| 6 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 5 |
| 6 |
| 1 |
| 6 |
| 1 |
| 6 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
A、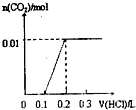 |
B、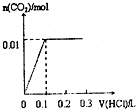 |
C、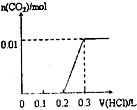 |
D、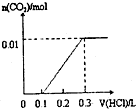 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、属于氧化物 | B、属于硫酸盐 |
| C、属于钾盐 | D、属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液体积(ml) | 标准盐酸体积(ml) | |
| 滴定前刻度(ml) | 滴定后刻度(ml) | ||
| 第一次 | 10.00 | 0.20 | 20.50 |
| 第二次 | 10.00 | 0.40 | 20.80 |
| 第三次 | 10.00 | 4.00 | 24.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 制备阿司匹林的合成路线(用下面示例中的合成路线流程图表示,同时注意所选试剂的合理性).示例:CH2=CH2
制备阿司匹林的合成路线(用下面示例中的合成路线流程图表示,同时注意所选试剂的合理性).示例:CH2=CH2| HBr |
| NaOH |
| 水/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
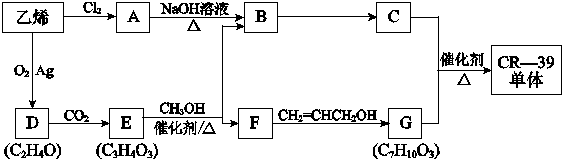
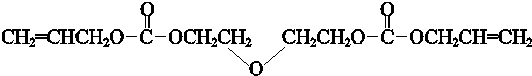
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 常温下状态 | 溶解性 | 稳定性 |
| 白色固体 | 易溶于水和乙醇,难溶于CCl4 | 在干燥空气中稳定,在湿空气中放出氨转化为NH4HC03,59时分解为NH3和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com