
下列化学反应对应的离子方程式表示正确的是
A.FeCl3溶液与Cu的反应:Cu+Fe3+===Cu2++Fe2+
B.NH4HCO3溶于过量的NaOH溶液中:HCO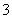 +OH-===CO
+OH-===CO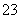 +H2O
+H2O
C.少量SO2通入苯酚钠溶液中: C6H5O-+SO2+H2O===C6H5OH+HSO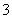
D.FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2===2Fe3++4Cl-+Br2
【知识点】离子方程式的书写
【答案解析】D 解析:A、电荷不守恒,故A错误;
B、铵根也要和氢氧化钠反应,故B错误;
C、由于HSO3- 酸性比C6H5OH 强,少量的SO2是形成SO32- 而不是HSO3-,故C错误;D、向FeBr2通入等物质的量的Cl2,二者反应生成氯化铁、溴,离子反应方程式为:2Fe2++2Br+2Cl2═2Fe3++Br2+4Cl-,,故D正确;
故答案选D
【思路点拨】本题考查了离子反应方程式的书写,涉及氧化还原反应,气体、沉
淀、弱电解质、单质等物质都要写化学式,书写时要遵循原子守恒、电荷守恒、
转移电子守恒,注意D中离子反应先后顺序,题目难度中等。


科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
①锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率
②镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
③电镀时,应把镀件置于电解槽的阴极
④冶炼铝时,把氧化铝加入液态冰晶石中成为熔融体后电解
⑤钢铁表面常易锈蚀生成Fe2O3·nH2O
A.①②③④⑤ B.①③④⑤ C.①③⑤ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
海藻中含有丰富的、以离子形式存在的碘元素.如图是实验室从海藻里提取碘的流程的一部分.

回答下列问题:
(1)步骤①、③的操作分别是 ▲ ▲ 。
(2)步骤②的离子反应方程式: ▲ 。步骤②中Cl2应 ▲ (填少量或适量或过量)。
(3)在步骤②中若不用Cl2,则下列氧化剂中最好选用 (填代号): ▲ 。
A.浓硫酸 B.新制氯水 C.高锰酸钾溶液 D.双氧水
(4)步骤③中应加入的有机溶剂是 ▲ ,而不能用 ▲ 等有机溶剂。
(5)能否用淀粉溶液检验步骤②的反应有否进行完全 ▲ (填能或否),其理由是:
▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中错误的是( )
①根据红外光谱图的分析可以初步判断有机物中具有哪些基团
②分子组成相差一个或几个CH2原子团的有机物是同系物
③同系物一定同类,且电子数之差一定为7的整数倍
④互为同分异构体的两种有机物由于结构不同,所以其物理性质有差别,化学性质也一定不相似
A. 只有①②③ B.①②③④ C. 只有①③④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献。Grignard试剂的合成方法是:RX+Mg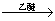 RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
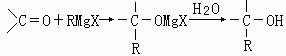
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的六元环的物质J,该物质具有一定的对称性,合成线路如下:
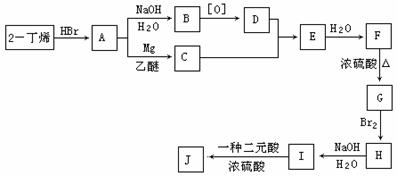
请按要求填空:
(1) 3,4-二甲基-3-己醇是: (填代号),E的结构简式是 ;
(2)C→E的反应类型是 ,F→G的反应类型是 ;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B ,
B→D ,
F→G 。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1) ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是________。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如下:
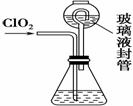

(2) 写出电解时发生反应的化学方程式:____________。
(3) 除去ClO2中的NH3可选用的试剂是________。(填序号)
A.饱和食盐水 B.碱石灰
C.浓硫酸 D.水
(4) 测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol·L-1硫代硫酸钠标准溶液滴定(I2+2S2O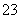 = 2I-+S4O
= 2I-+S4O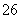 ),共用去V mL硫代硫酸钠溶液。
),共用去V mL硫代硫酸钠溶液。
①装置中玻璃液封管的作用是_______________________________________。
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式__________________。
③滴定终点的现象是________________________________________________。
④测得通入ClO2的质量m(ClO2)=________。(用含c、V的代数式表示)
(5) 用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO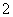 。2001年我国卫生部规定,饮用水的ClO
。2001年我国卫生部规定,饮用水的ClO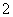 含量应不超过0.2 mg·L-1。若饮用水中ClO
含量应不超过0.2 mg·L-1。若饮用水中ClO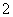 的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于蒸馏操作的有关叙述不正确的是( )
|
| A. | 蒸馏操作主要仪器是:蒸馏烧瓶、酒精灯、铁架台、冷凝管、锥形瓶、温度计 |
|
| B. | 蒸馏操作使用的温度计的水银球应插入到液体内 |
|
| C. | 在蒸馏烧瓶内放入少量碎瓷片,目的是防止暴沸 |
|
| D. | 冷凝管进出水的方向是下进上出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
4.8gO2和0.2molCO2,质量之比是 ,在同温同压下的体积之比是 .相同物质的量的SO2和SO3,所含分子的数目之比为 ,所含O原子的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g
2NH3(g ) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为
) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为 φ,下列说法中正确的是
φ,下列说法中正确的是
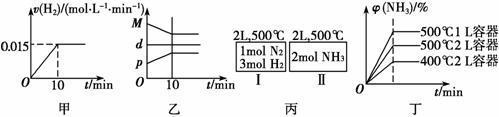
A.若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图甲所示
B.反应过程中 ,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙
,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙
C.如图丙所示,容器Ⅰ和Ⅱ达到平衡时所需要的时间可能不同
D.若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com