
4.8gO2和0.2molCO2,质量之比是 ,在同温同压下的体积之比是 .相同物质的量的SO2和SO3,所含分子的数目之比为 ,所含O原子的物质的量之比为 .
| 阿伏加德罗定律及推论;物质分子中的原子个数计算.. | |
| 专题: | 阿伏加德罗常数和阿伏加德罗定律. |
| 分析: | 根据m=nM计算二氧化碳的质量,根据n=计算氧气的物质的量,根据V=nVm计算其体积之比,根据N=nNA计算其分子数之比,结合分子构成计算O原子的物质的量之比. |
| 解答: | 解:n(O2)= 同温同压下,气体摩尔体积相等,二者的物质的量之比等于其体积之比,所以氧气和二氧化碳的体积之比=0.15mol:0.2mol=3:4; 相同物质的量的二氧化硫和三氧化硫,其分子数之比等于物质的量之比,所以二者的分子数之比为1:1,每个二氧化硫分子中含有2个O原子、每个三氧化硫分子中含有3个O原子,所以二氧化硫和三氧化硫中O原子的物质的量之比为2:3, 故答案为:6:11;3:4;1:1;2:3. |
| 点评: | 本题考查阿伏伽德罗定律及其推论,熟练掌握物质的量基本公式并灵活运用是解本题关键,知道各个物理量之间的关系,同时考查学生分析问题、计算能力,题目难度不大. |


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
你认为下列数据可信的是(已知1nm=10-9m)
A.某元素的原子半径是0.160 nm B.某常见气体的密度为1.8 g/cm3
C.某澄清石灰水的浓度是4.0 mol/L D.某溶液中溶质的质量分数120 %
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应对应的离子方程式表示正确的是
A.FeCl3溶液与Cu的反应:Cu+Fe3+===Cu2++Fe2+
B.NH4HCO3溶于过量的NaOH溶液中:HCO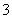 +OH-===CO
+OH-===CO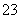 +H2O
+H2O
C.少量SO2通入苯酚钠溶液中: C6H5O-+SO2+H2O===C6H5OH+HSO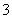
D.FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2===2Fe3++4Cl-+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
某原子的摩尔质量是Mg•mol﹣1,则一个该原子的真实质量约为( )
|
| A. | M g | B. | 1/M g | C. | M/6.02×1023 g | D. | 6.02×1023/M g |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是
①常温常压下,18g14CH4所含中子数目为8 NA
②1L0.1mol·L-1的氨水中有0.1NA个NH4+
③1mol Na2O2中含有NA个阴离子
④1L1mol·L-1NaClO 溶液中含有ClO-的数目为NA
⑤78g 苯含有C=C双键的数目为3NA
⑥0.1molN2和0.3molH2在某密闭容器中充分反应,转移电子的数目为0.6NA
⑦60gSiO2晶体中含有硅氧键的数目为4NA
A.①③⑦ B.②③⑥ C.②④⑥ D.①④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
t℃时,水的离子积为KW。在该温度下,混合可溶性的一元酸HA和一元碱BOH的溶液,下列有关混合液的各种关系中,可确认混合液呈中性的是
A.pH=7 B.c(OH-)=c(H+)=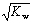
C.c(A-) > c(B+) D.c(H+)-c(OH-)=c(A-)-c(B+)
查看答案和解析>>
科目:高中化学 来源: 题型:
放热反应CO(g)+H2O(g)  CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.K2和K1的单位均为mol·L-1 B.K2>K1
C.c2(CO)=c2(H2O) D.c1(CO)>c2(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石来制取纯净的Al2O3、K2FeO4和H2SO4的工艺流程如图所示:
(1)“焙烧”过程中Al2(SO4)3和S发生反应的化学方程式为 ;
若生成102g Al2O3,转移的电子数目为 ;
(2)生成沉淀Ⅰ时的离子方程式为 ;
(3)写出化学式:沉淀Ⅱ是 ;
(4)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀Ⅰ,证明沉淀Ⅰ已洗涤干净的实验操作和现象是 ;
(5)从滤液中得到K2SO4晶体的方法是 ;
(6)K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com