
| A、FeCl2 |
| B、CuCl2 |
| C、FeCl3 |
| D、AlCl3 |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
| A、6.02×1023个12C原子数就是阿伏加德罗常数 |
| B、1mol氧的质量是32g |
| C、氢原子的摩尔质量是1.008g |
| D、4.9gH2SO4是0.05molH2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将过量的二氧化碳通入氢氧化钠溶液:CO2+2OH-═CO32-+H2O |
| B、氯化铝溶液中加入过量浓氨水:Al3++4OH-═AlO2-+2H2O |
| C、氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ |
| D、碳酸钙和盐酸反应:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,11.2 L的甲烷气体含有甲烷分子数为0.5NA个 |
| B、标准状况下,11.2 L SO3中含有个0.5NA个SO3分子 |
| C、常温下14 g乙烯和丙烯的混合物中总原子数为3NA个 |
| D、1L0.1mol?L-1Na2SO3溶液中含有SO32-的个数小于0.1NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 液体 | 固体 | 混合前温度 | 混合后最高温度 |
| ① | 35mL水 | 2.5g NaHCO3 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2g Na2CO3 | 20℃ | 24.3℃ |
| ③ | 35mL盐酸 | 2.5g NaHCO3 | 20℃ | 16.2℃ |
| ④ | 35mL盐酸 | 3.2g Na2CO3 | 20℃ | 25.1℃ |
| A、仅通过实验③即可判断反应Ⅰ是吸热反应 |
| B、仅通过实验④即可判断反应Ⅱ是放热反应 |
| C、通过实验可判断出反应Ⅰ、Ⅱ分别是吸热反应、放热反应 |
| D、通过实验可判断出反应Ⅰ、Ⅱ分别是放热反应、吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2与Na2CO3 |
| B、NaHCO3和Na2CO3 |
| C、NaOH和Na2O2 |
| D、Na2CO3与NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
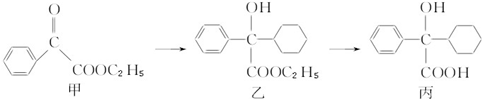
| A、化合物乙能发生消去反应,且生成的有机物能和Br2发生加成反应 |
| B、化合物丙能和FeCl3溶液发生显色反应 |
| C、化合物甲中的含氧官能团有羰基和酯基 |
| D、化合物乙与NaOH水溶液在加热条件下反应可生成化合物丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铊是银白色金属 |
| B、Tl(OH)3和Al(OH)3一样是两性氢氧化物 |
| C、能形成+3价的化合物 |
| D、与稀硝酸作用生成硝酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
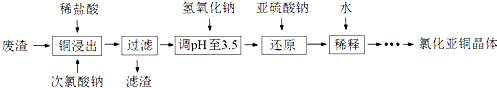

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com