
【题目】在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计实验图以确认上述混合气体中有C2H4和SO2 . 回答下列问题: 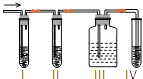
(1)实验室制备乙烯的反应方程式是:
(2)I、Ⅱ、Ⅲ、IV装置可盛放的试剂是I;Ⅱ;Ⅲ;Ⅳ . (将下列有关试剂的序号填入空格内). A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(3)能说明SO2气体存在的现象是 .
(4)使用装置II的目的是 .
(5)使用装置III的目的是 .
(6)确定含有乙烯的现象是 .
【答案】
(1)CH3CH2OH ![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
(2)A;B;A;D
(3)Ⅰ中品红溶液褪色
(4)除去SO2 , 以免干扰乙烯的检验
(5)检验SO2是否已经被完全除去
(6)Ⅲ中的品红不褪色,Ⅳ中的酸性高锰酸钾溶液褪色
【解析】解:(1)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应的化学方程式为:CH3CH2OH ![]() CH2=CH2↑+H2O, 故答案为:CH3CH2OH
CH2=CH2↑+H2O, 故答案为:CH3CH2OH ![]() CH2=CH2↑+H2O;(2)检验二氧化硫用品红溶液,检验乙烯用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除尽SO2 , 再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,因装置I用来检验SO2 , 试管中品红溶液褪色,说明含有SO2 , 装置II试管装有NaOH溶液除去SO2 , 装置III试管通过品红溶液不褪色确认SO2已除干净,装置IV 通过高锰酸钾酸性溶液褪色检验乙烯,
CH2=CH2↑+H2O;(2)检验二氧化硫用品红溶液,检验乙烯用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除尽SO2 , 再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,因装置I用来检验SO2 , 试管中品红溶液褪色,说明含有SO2 , 装置II试管装有NaOH溶液除去SO2 , 装置III试管通过品红溶液不褪色确认SO2已除干净,装置IV 通过高锰酸钾酸性溶液褪色检验乙烯,
故答案为:A;B;A;D;(3)装置I用来检验SO2 , 试管中品红溶液褪色,说明含有SO2 ,
故答案为:Ⅰ中品红溶液褪色;(4)装置Ⅱ试管装有NaOH溶液,目的是除去SO2 , 以免干扰乙烯的检验,
故答案为:除去SO2 , 以免干扰乙烯的检验;(5)装置Ⅲ试管通过品红溶液不褪色,从而确定SO2已除干净,
故答案为:检验SO2是否已经被完全除去;(6)装置Ⅳ通过高锰酸钾酸性溶液褪色检验乙烯,如果Ⅲ中的品红不褪色,Ⅳ中的酸性高锰酸钾溶液褪色,则证明有乙烯生成,
故答案为:Ⅲ中的品红不褪色,Ⅳ中的酸性高锰酸钾溶液褪色.
(1)实验室制备乙烯所用的原料为乙醇,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃,据此写出反应的化学方程式;(2)多种产物需检验时,应考虑先后顺序,本题中先检验二氧化硫,然后除去二氧化硫,再检验产物中有乙烯;(3)根据二氧化硫能漂白品红检验二氧化硫的存在;(4)氢氧化钠溶液能吸收二氧化硫,据此可以除去混合气体中的二氧化硫;(5)品红溶液不褪色确认SO2已除干净,避免二氧化硫对乙烯检验的干扰;(6)装置Ⅲ中确定无二氧化硫,装置Ⅳ中气体与酸性高锰酸钾溶液褪色证明混合气体中含有乙烯.


科目:高中化学 来源: 题型:
【题目】某稀土元素R的精矿样品中,R的氧化物的质量分数为0.8515.20.2g该样品与100mL 1mol/L稀硫酸恰好完全反应(杂质不反应),生成ROSO4和H2O,则R的相对原子质量约为( )
A.78
B.140
C.156
D.172
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH . (填“>7”、“<7”、或“无法确定”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属M在酸性或碱性溶液中均可与HNO3发生氧化还原反应,转化关系如图(部分生成物未列出): 
已知:C、D、E、G均为气体,且G为单质;将D通入A溶液产生白色沉淀;将F逐滴加入B溶液至过量,先产生白色沉淀,随后沉淀消失.
请回答下列问题:
(1)写出下列物质的化学式:M、F、G .
(2)A溶液与B溶液混合也能产生白色沉淀,写出该反应的离子方程式 .
(3)除去气体C中的气体E的化学方法是 .
(4)将10mL充满气体E和O2混合气的试管倒扣在水槽中,反应后试管中残留1mL无色气体,则试管中气体E的体积是mL
(5)D→C反应的化学方程式是 .
(6)M与NO3﹣在碱性条件下反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,以甲醇燃料电池作为电源实现下列电解过程.乙池中发生反应的离子方程式为 . 当甲池中增重16g时,丙池中理论上产生沉淀质量的最大值为g. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).请回答下列问题: 
(1) A、B中的反应物分别是浓盐酸和MnO2 . 写出所发生的化学方程式 , 进入装置C的气体中所含杂质是、 .
【答案】MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O| HCl| H2O
MnCl2+Cl2↑+2H2O| HCl| H2O
(1)A、B中的反应物分别是浓盐酸和MnO2 . 写出所发生的化学方程式 , 进入装置C的气体中所含杂质是、 .
(2)漂白粉的有效成分是(填化学式);D中所发生的化学反应的离子方程式是 .
(3)此实验所得漂白粉的Ca(ClO)2产率偏低.该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应: ①温度较高时氯气与消石灰反应生成Ca(ClO3)2 , 为避免此副反应的发生,可采取的措施是
②为避免另一副反应的发生,应采取的措施是 .
(4)若将该实验中残留的Cl2 , 缓慢通入KI溶液至过量,则溶液先变黄后变无色,且可检测到HIO3;写出并配平该“变无色”反应的化学方程式:5Cl2+I2+→若将KI改为KBr溶液,则溶液变为色,未检测到HBrO3的存在.由上述事实推测,Cl2、HIO3、HBrO3的氧化性由强到弱的次序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
A.![]() 1,4﹣二甲基丁烷
1,4﹣二甲基丁烷
B.![]() 3﹣甲基丁烯
3﹣甲基丁烯
C.![]() 2﹣甲基丁烷
2﹣甲基丁烷
D.CH2Cl﹣CH2Cl 二氯乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过NO传感器可监测NO的含量,其工作原理如图所示.下列说法错误的是( ) 
A.该装置实现化学能向电能的转化
B.该电池的总反应为2NO+O2═2NO2
C.NiO电极的电极反应式:NO+O2﹣﹣2e﹣═NO2
D.当有2.24L的O2参与反应时,转移了0.4mole﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B.氯化铝溶液中加入过量氨水制取氢氧化铝:Al3++3NH3·H2O=Al(OH)3↓+3 ![]()
C.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
D.氢氧化钠溶液中通入少量二氧化硫气体 :SO2+OH= ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com