
【题目】山梨酸(CH3—CH=CH—CH=CH—COOH)是一种常用的食品防腐剂。下列关于山梨酸性质的叙述中,不正确的是
A. 可与钠反应B. 可与碳酸钠溶液反应
C. 可与溴的四氯化碳溶液发生取代反应D. 可生成高分子化合物
 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】已知化学反应①: Fe(s)+CO2(g)═FeO(s)+CO(g),其平衡常数为K1;化学反应②:
Fe(s)+H2O(g)═FeO(s)+H2(g),其平衡常数为K2 . 在温度
973K和1173K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)=CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3= .
(3)根据反应①与②可推导出K1、K2与K3之间的关系式 . 据此关系式及上表数据,也能推断出反应③是(填“吸热”或“放热”)反应,要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有(填写序号). A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
(4)图甲、乙分别表示反应③在t1时刻达到平衡、在t2时刻因改变某个条件而发生变化的情况: ①图甲中t2时刻发生改变的条件是 .
②图乙中t2时刻发生改变的条件是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的叙述中,正确的是( )
A.有单质参加的反应一定是氧化还原反应
B.燃烧反应必须有氧气作氧化剂
C.2Fe+3Cl2═2FeCl3; Fe+S ![]() FeS 由此可以判断氧化性:Cl2>S
FeS 由此可以判断氧化性:Cl2>S
D.Mg在化学反应中失去2个电子,而Al在化学反应中失去3个电子,因此还原性Al>Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同的温度和压强下,二氧化碳和笑气(化学式为N2O)的体积相同,则下列它们的( )一定相同。
(1)分子数 (2)原子数 (3)密度 (4)质量 (5)物质的量
A.只有(1)(5) B.只有(1)(2)(4)(5)
C.只有(2)(3)(4)(5) D.(1)(2)(3)(4)(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( ) 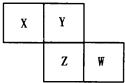
A.Z的单质与氢气反应较Y剧烈
B.X、Y形成的化合物都易溶于水
C.只由这四种元素不能组成有机化合物
D.最高价氧化物对应水化物的酸性W比Z弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列4个电极反应
①Br2+2e-=2Br- ②2Br-—2e-=Br2 ③Zn-2e-=Zn2+ ④Zn2++2e-=Zn其中表示正极反应和负极反应的分别是( )
A.①和③B.②和①C.③和①D.④和①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的一些常见物质之间的转化关系中(有些反应中的水、部分产物及反应条件未列出),已知反应①是工业制硫酸时沸腾炉中的反应,A是由两种元素组成的化合物且元素的质量比为7:8,B、M为非金属单质,E、K为金属单质,其中B为地壳中含量最多的非金属元素的单质,E为地壳中含量最多的金属元素的单质. 
(1)反应②的一种用途为 .
(2)M的化学式为 .
(3)反应①的化学方程式为 .
(4)I的水溶液与K反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙醇、乙酸的说法,错误的是
A.乙醇和乙酸都可以发生酯化反应
B.乙醇和乙酸都可以与钠反应生成氢气
C.乙醇和乙酸都能发生氧化反应
D.乙醇和乙酸都含有羟基,二者是同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是( )
A.2SO2(g)+O2(g)2SO3(g)△H<0
B.4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H<0
C.H2(g)+I2(g)2HI(g)△H>0
D.2A(g)+B(g)2C(g)△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com