
| A. | 反应速率与I2的浓度有关 | |
| B. | HI在反应Ⅰ中是氧化产物 | |
| C. | 反应焓变的绝对值等于190kJ•mol-1 | |
| D. | 乙醛的反应速率主要取决于反应Ⅱ |
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
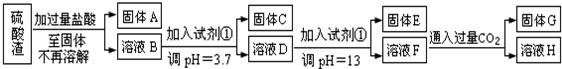
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
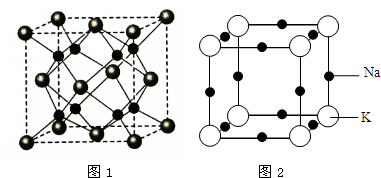
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇分子结构中不存在手性碳 | |
| B. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | SO2、SO3都是极性分子 | |
| D. | 原子晶体中原子以共价键结合,具有键能大、硬度大的特性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com