
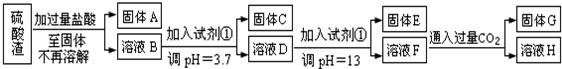
分析 硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸;向溶液B中加试剂①并调节溶液的PH值为3.7,结合题意溶液pH=3.7时Fe3+已经沉淀完全知,试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,固体C是氢氧化铁;向溶液D中加入试剂①并调节溶液的PH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝、H为碳酸氢钠.
(1)根据二氧化硅和氢氧化钠的性质写出相应的化学反应方程式;
(2)能使铁离子产生沉淀,而铝离子不产生沉淀的物质只能是强碱;
(3)在强碱性条件下,铝元素以偏铝酸根离子存在,镁元素以氢氧化镁存在;
(4)H中溶质为碳酸氢钠;
(5)根据c(Mg2+)=$\frac{Ksp}{C(O{H}^{-})^{2}}$计算.
解答 解:硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸;向溶液B中加试剂①并调节溶液的PH值为3.7,结合题意溶液pH=3.7时Fe3+已经沉淀完全知,试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,固体C是氢氧化铁;向溶液D中加入试剂①并调节溶液的PH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝、H为碳酸氢钠,
(1)通过以上分析知,A是二氧化硅,二氧化硅是酸性氧化物,能和强碱反应生成盐和水,
所以反应方程式为:SiO2+2OH-=SiO32-+H2O.
故答案为:SiO2+2OH-=SiO32-+H2O;
(2)向溶液B中加试剂①并调节溶液的PH值为3.7,结合题意知,溶液pH=3.7时Fe3+已经沉淀完全知,试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,符合条件的是A选项.
故选A;
(3)在强碱性条件下,铝元素以偏铝酸根离子存在,镁元素以氢氧化镁存在,当溶液的PH=13时,溶液呈强碱性,如果pH过小,可能导致的后果是镁离子沉淀不完全或氢氧化铝溶解不完全等.
故答案为:镁离子沉淀不完全或氢氧化铝溶解不完全等;
(4)H中溶质为碳酸氢钠,故答案为:NaHCO3;
(5)c(Mg2+)=$\frac{Ksp}{C(O{H}^{-})^{2}}$=$\frac{5.6×1{0}^{-12}}{(0.1)^{2}}mol/L$=5.6×10-10 mol/L
故答案为:5.6×10-10 mol/L.
点评 本题考查了物质的分离、提纯的方法选择及应用,实验方案设计和评价,为高考常见题型,侧重于学生的分析能力和计算能力的考查,题目难度较大,明确各物质的性质是解本题的关键,本题注意溶度积的相关计算.


科目:高中化学 来源: 题型:选择题
| A. | 长颈漏斗 | B. | 分液漏斗 | C. | 圆底烧瓶 | D. | 蒸馏烧瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
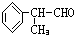
 .
. 、
、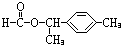 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到干燥的有色布条上 | ||
| ③ | 将足量的氯水滴加到Na2CO3溶液中 | 氯水中 含有H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该原电池的正极是锌 | B. | 铜电极发生还原反应 | ||
| C. | 原电池中Cu2+向锌极移动 | D. | 铜极有气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
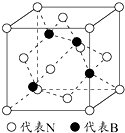 利用所学化学知识解答问题:
利用所学化学知识解答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率与I2的浓度有关 | |
| B. | HI在反应Ⅰ中是氧化产物 | |
| C. | 反应焓变的绝对值等于190kJ•mol-1 | |
| D. | 乙醛的反应速率主要取决于反应Ⅱ |
查看答案和解析>>
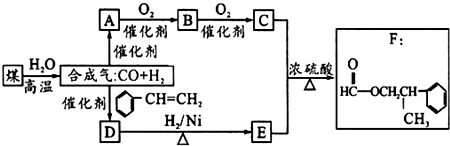
科目:高中化学 来源: 题型:解答题
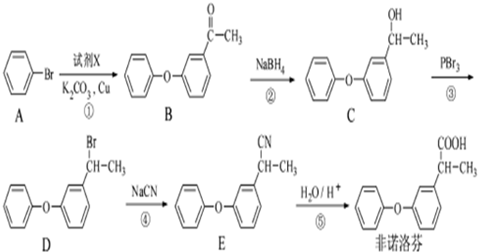
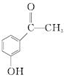 .
.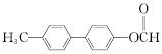 .
.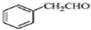 为原料制备
为原料制备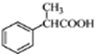 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
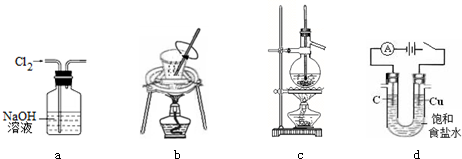
| A. | 用图a所示装置除去Cl2中含有的HCl | |
| B. | 用图b所示装置进行从海带中提取碘实验时灼烧海带 | |
| C. | 用图c所示装置分离沸点相差较大的互溶液体混合物 | |
| D. | 用图d所示装置进行电解法制Cl2、H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com