
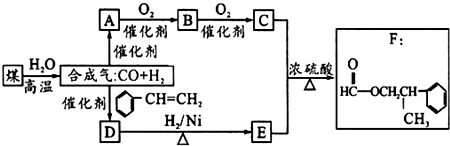
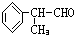
 .
. 、
、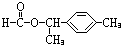 .
.分析 D的分子式为C9H10O,且能发生银镜反应,说明含有醛基,D和氢气发生加成反应生成醇E,根据甲酸苯丙酯(F)的结构简式及E的官能团知,C是甲酸,其结构简式为HCOOH,E的结构简式为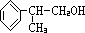 .C是甲酸,逆推可得,B是甲醛,A是甲醇.D和氢气发生加成反应生成E,所以D的结构简式为:
.C是甲酸,逆推可得,B是甲醛,A是甲醇.D和氢气发生加成反应生成E,所以D的结构简式为: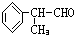 ,以此解答该题.
,以此解答该题.
解答 解:D的分子式为C9H10O,且能发生银镜反应,说明含有醛基,D和氢气发生加成反应生成醇E,根据甲酸苯丙酯(F)的结构简式及E的官能团知,C是甲酸,其结构简式为HCOOH,E的结构简式为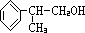 .C是甲酸,逆推可得,B是甲醛,A是甲醇.D和氢气发生加成反应生成E,所以D的结构简式为:
.C是甲酸,逆推可得,B是甲醛,A是甲醇.D和氢气发生加成反应生成E,所以D的结构简式为: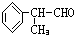 ,
,
(1)由以上分析可知B为甲醛,结构简式为HCHO,D为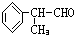 ,故答案为:HCHO;
,故答案为:HCHO;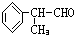 ;
;
(2)D为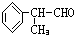 ,含有醛基,与氢气发生加成反应生成E,故答案为:加成反应;
,含有醛基,与氢气发生加成反应生成E,故答案为:加成反应;
(3)B为甲醛,含有醛基,可在加热条件下与氢氧化铜浊液发生氧化反应,方程式为HCHO+2Cu(OH)2$\stackrel{△}{→}$HCOOH+Cu2O↓+2H2O,
故答案为:HCHO+2Cu(OH)2$\stackrel{△}{→}$HCOOH+Cu2O↓+2H2O;
(4)C为HCOOH,E为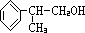 ,二者可在浓硫酸作用下发生酯化反应,反应的方程式为
,二者可在浓硫酸作用下发生酯化反应,反应的方程式为 ,
,
故答案为: ;
;
(5)F对应的同分异构体中①属于酯类,且能发生银镜反应,则应含有-OOCH结构,即为甲酸酯,②苯环上的一氯取代物只有两种结构,说明苯环结构对称,可能含有两个对位基团或三个基团,③分子结构中只有两个甲基.则对应的结构可能为: 、
、 、
、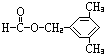 、
、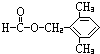 ,
,
故答案为: ;
; 等.
等.
点评 本题考查有机物的推断,为高频考点,题目难度中等,注意以A、B、C的转化关系以及F的结构用正逆推相结合的方法进行推断,注意把握有机物官能团的转化以及官能团的性质,为解答该类题目的关键.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 江河入海口三角洲的形成通常与胶体的性质有关 | |
| B. | 明矾净水过程中涉及化学变化 | |
| C. | Fe(OH)3胶体与食盐溶液混合将产生聚沉观象 | |
| D. | 沸水中滴加适量饱和FeCl3溶液,可形成带正电荷的胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇分子结构中不存在手性碳 | |
| B. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | SO2、SO3都是极性分子 | |
| D. | 原子晶体中原子以共价键结合,具有键能大、硬度大的特性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com