
 利用所学化学知识解答问题:
利用所学化学知识解答问题:分析 (1)Cu元素原子核外电子数为29,其基态原子的电子排布式为1s22s22p63s23p43d104s1,Cu原子失去4s、3d能级的1个电子形成Cu2+;根据构造原理书写Cu+基态核外电子排布式,轨道处于全空、半满或全满时最稳定;根据Cu的外围电子排布式分析;
(2)A、HCHO中的中心原子为sp2杂化;
B、甲醛中含有羟基,与水可以形成氢键;
C、苯中碳碳键含有6个σ键,每个碳氢键含有一个σ键,苯分子中一共含有12个,故C错误;
D、分子晶体晶体的熔点、沸点比原子晶体低;
(3)碳为四价,氮为三价,氧为两价,氰酸(HOCN)是一种链状分子,且其分子内各原子最外层均已达到稳定结构,故N≡C-O-H;氰酸中C原子形成2个σ键、没有孤电子对;CN-中C原子与1个单位负电荷用N原子替换可得CN-等电子体的单质;
(4)①形成配离子具备的条件为:中心原子具有空轨道,配体具有孤对电子对;
②六氰合亚铁离子[Fe(CN)6]4-中Fe2+与CN-形成配位键,CN-中存在C≡N三键,为极性共价键,三键中有1个σ键2个π键;
(5)根据均摊法计算晶胞中B、N原子数目,进而计算晶胞中含有B、N原子总体积,计算晶胞的体积,晶胞的空间利用率=$\frac{晶胞中B、Ni原子总体积}{晶胞体积}$×100%.
解答 解:(1)Cu元素原子核外电子数为29,其基态原子的电子排布式为1s22s22p63s23p63d104s1,Cu原子失去4s、3d能级的1个电子形成Cu2+,Cu2+的核外电子排布式为:1s22s22p63s23p63d9;Cu+基态核外电子排布式1s22s22p63s23p63d10或[Ar]3d10 ,原子轨道处于全空、半满或全满时最稳定,结构上Cu2+为3d9,而Cu+为3d10全充满更稳定;Cu的外围电子排布式为3d104s1,Cu属于第IB族元素,在周期表中位于ds区;
故答案为:1s22s22p63s23p63d9;结构上Cu2+为3d9,而Cu+为3d10全充满更稳定;ds;
(2)a.HCHO中的中心原子为sp2杂化,故a错误;
b.因为HCHO与水分子间能形成氢键,所以HCHO易溶于水,故b正确;
c.苯中碳碳键含有6个σ键,每个碳氢键含有一个σ键,苯分子中一共含有12个σ键,故c错误;
d.CO2为分子晶体,二氧化硅是原子晶体,所以CO2晶体的熔点、沸点都比二氧化硅晶体的低,故d正确;
故答案为:ac;
(3)碳为四价,氮为三价,氧为两价,氰酸(HOCN)是一种链状分子,且其分子内各原子最外层均已达到稳定结构,故N≡C-O-H;氰酸中C原子形成2个σ键、没有孤电子对,C的杂化类型为sp杂化;CN-中C原子与1个单位负电荷用N原子替换可得CN-等电子体的单质为N2,
故答案为:N≡C-O-H;sp杂化;N2;
(4)①形成配离子具备的条件为:中心原子具有空轨道,配体具有孤对电子对;
故答案为:具有孤对电子;
②六氰合亚铁离子[Fe(CN)6]4-中Fe2+与CN-形成配位键,CN-中存在C≡N三键,为极性共价键,三键中有1个σ键2个π键,所以CN-中共价键、配位键、σ键、π键;
故答案为:b;
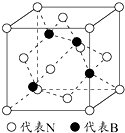
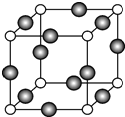
(5)方氮化硼晶胞结构与金刚石类似,晶胞结构图为 ,B占据立方体的8个顶点和6个面心,所以B原子数目为=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,N原子数目=4;B原子半径为bpm,则晶胞中B原子总体积=4×$\frac{4}{3}$×π×(b)3pm3=$\frac{16}{3}$πb3pm3,N原子半径为a pm,则晶胞中N原子总体积=4×$\frac{4}{3}$×π×(a)3pm3=$\frac{16}{3}$πa3cm3,故晶胞中B、N原子总体积=$\frac{16}{3}$π(a3+b3)pm3,根据硬球接触模型可知,体对角线四分之一处的原子与顶点上的原子紧贴,设晶胞边长为x,所以$\frac{1}{4}$×($\sqrt{3}$x)=a+b,x=$\frac{4}{\sqrt{3}}$(a+b),晶胞体积=x3=$\frac{64}{3\sqrt{3}}$(a+b)3pm3,所以间利用率=$\frac{\frac{16}{3}π({a}^{3}+{b}^{3})p{m}^{3}}{\frac{64}{3\sqrt{3}}(a+b)^{3}pm{\;}^{3}}$×100%=$\frac{\sqrt{3}π({a}^{3}+{b}^{3)}}{4(a+b){\;}^{3}}$×100%;
,B占据立方体的8个顶点和6个面心,所以B原子数目为=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,N原子数目=4;B原子半径为bpm,则晶胞中B原子总体积=4×$\frac{4}{3}$×π×(b)3pm3=$\frac{16}{3}$πb3pm3,N原子半径为a pm,则晶胞中N原子总体积=4×$\frac{4}{3}$×π×(a)3pm3=$\frac{16}{3}$πa3cm3,故晶胞中B、N原子总体积=$\frac{16}{3}$π(a3+b3)pm3,根据硬球接触模型可知,体对角线四分之一处的原子与顶点上的原子紧贴,设晶胞边长为x,所以$\frac{1}{4}$×($\sqrt{3}$x)=a+b,x=$\frac{4}{\sqrt{3}}$(a+b),晶胞体积=x3=$\frac{64}{3\sqrt{3}}$(a+b)3pm3,所以间利用率=$\frac{\frac{16}{3}π({a}^{3}+{b}^{3})p{m}^{3}}{\frac{64}{3\sqrt{3}}(a+b)^{3}pm{\;}^{3}}$×100%=$\frac{\sqrt{3}π({a}^{3}+{b}^{3)}}{4(a+b){\;}^{3}}$×100%;
故答案为:4;4;$\frac{{\sqrt{3}π({{a^3}+{b^3}})}}{{4{{({a+b})}^3}}}$×100%.
点评 本题是对物质结构知识的综合考查,涉及核外电子排布规律、分子结构与性质、杂化轨道、晶胞计算、空间利用率的计算等,需要学生具有一定的空间想象与数学计算能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
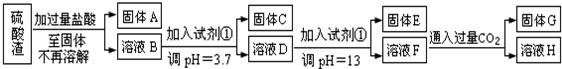
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期元素且最外层只有2对成对电子,F元素与Cr元素位于同一周期的副族元素中且基态原子的最外层电子数与Cr原子相同.
已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期元素且最外层只有2对成对电子,F元素与Cr元素位于同一周期的副族元素中且基态原子的最外层电子数与Cr原子相同.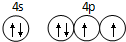 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ag+、NO3-、Cl- | B. | K+、Ba2+、Cl-、CO32- | ||
| C. | Na+、Fe3+、NO3-、SO42- | D. | Na+、Mg2+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在精炼铜或电镀铜的过程中,当阳极析出铜64g转移电子数均为2NA | |
| B. | 24g石墨烯(单层石墨)中含有六元环的个数为NA | |
| C. | 1.0mo1•L-1的Na2CO3溶液中所含阴离子数大于NA个 | |
| D. | 1mol的甲基(-CH3)中所含的电子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com