
【题目】如图所示装置中,试管内的FeI2溶液中滴有KSCN溶液,实验中控制通入Cl2的速度,试管内先观察到紫色,后观察到红色。下列说法正确的是( )

A.若Cl2中含较多HCl,实验过程中会产生倒吸现象
B.通入足量Cl2后,振荡试管,下层变紫色,上层变红色
C.该实验可验证氧化性:Cl2>I2>Fe3+
D.试管内反应的离子方程式可表示为Fe2++2I-+Cl2=I2+Fe3++2Cl-
科目:高中化学 来源: 题型:
【题目】化学活动课上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性良好)。请回答:
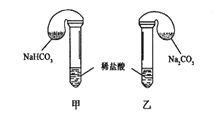
(1)各组反应开始时,____________(甲、乙)装置中的气球体积先变大,该装置中反应的化学反应方程式是_____________。
(2)当试管中不再有气体生成时,三组实验出现不同现象,试分析原因并填写下表的空格。
试剂用量 | 实验现象 (气球体积变化) | 分析原因 | |
第①组 | 0.42gNaHCO3 0.53gNa2CO3 3mL 4mol·L-1盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)= n(Na2CO3) V甲(CO2)= V乙(CO2) |
第②组 | 0.3gNaHCO3 0.3gNa2CO3 3mL 4 mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | A:___________ |
第③组 | 0.6gNaHCO3 0.6gNa2CO3 3mL 2 mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | B:______________ |
片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用化学方程式表示) C:___________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实解释正确的是( )
选项 | 现象 | 解释 |
A | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
B | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成有色产物能溶于浓硝酸 |
C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO |
D | 向盐酸中加入浓硫酸时产生白雾 | 说明浓硫酸具有脱水性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
①碳酸钙和盐酸(写出离子方程式)____________________________________。
②氢氧化钡溶液和硫酸铜溶液(写出离子方程式)________________________。
③Fe2(SO4)3(写出电离方程式)_________________________________________。
④H++OH-![]() H2O(写出对应的化学方程式)_______________________________。
H2O(写出对应的化学方程式)_______________________________。
⑤制取氢氧化铁胶体(写出对应的化学方程式) ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是

A. 由红外光谱可知,该有机物中至少有三种不同的化学键
B. 由核磁共振氢谱可知,该有机分子中有三种不同化学环境的氢原子
C. 仅由A的核磁共振氢谱无法得知其分子中的氢原子总数
D. 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是( )
A. 酸性氧化物:CO2、SiO2、SO2、NO2
B. 碱:NaOH、KOH、Ba(OH)2、纯碱
C. 混合物:盐酸 漂白粉 水煤气 氢氧化铁胶体
D. 碱性氧化物:Na2O2、CaO、MgO、Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 处于最低能量状态的原子叫基态原子
B. 2p3表示2p能级上有3个p轨道
C. 核外电子分层排布规律表明,多电子原子核外电子总是按能层次序从低到高依次填充
D. 同一原子中,2p、3p、4p能级的轨道数依次增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制480mL 0.2 mol·L-1 NaCl溶液,实验室只有含有少量硫酸钠的氯化钠样品,设计如下方案,请回答下列问题:

Ⅰ.粗盐提纯
(1)固体A的成分为________________(填化学式)。
(2)试剂2的化学式为_____________,判断试剂2是否过量的方法_______________,操作2的名称__________________。
Ⅱ.配制溶液
(1)用托盘天平称取氯化钠,其质量为________g。
(2)配制过程中需要使用的实验仪器除了托盘天平、药匙、量筒、玻璃棒、烧杯、胶头滴管外,还需要___________。
(3)下列主要操作步骤的正确顺序是①—____—_____— ____—④(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切
③将溶液转移到容量瓶中
④盖好瓶塞,反复上下颠倒,摇匀
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中
(4)下列情况对所配制的NaCl溶液浓度有何影响?(选填“偏大”、“偏小”或“无影响”)
①容量瓶用蒸馏洗涤后残留有少量的水________________;
②定容时,仰视容量瓶的刻度线________________;
③转移溶液时,玻璃棒的下端靠在容量瓶的刻度线以上的内壁________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com