
ͨ�����ǰѲ�1 molij��ѧ�������յ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С���Ժ�����ѧ����ǿ����Ҳ���Թ��㻯ѧ��Ӧ�ķ�Ӧ��(��H)����ѧ��Ӧ�Ħ�H���ڷ�Ӧ�ж��Ѿɻ�ѧ���ļ���֮���뷴Ӧ���γ��»�ѧ���ļ���֮�͵IJ
| ��ѧ�� | H��H | Cl��Cl | H��Cl |
| ����1 mol��ѧ��ʱ �ų�������(kJ/mol) | 436 | 243 | 431 |
�������Ȼ�ѧ����ʽ����ȷ����(����)
A. H2(g)��
H2(g)�� Cl2(g)===2HCl(g)����H����91.5 kJ/mol
Cl2(g)===2HCl(g)����H����91.5 kJ/mol
B��H2(g)��Cl2(g)===2HCl(g)����H����183 kJ/mol
C. H2(g)��
H2(g)�� Cl2(g)===HCl(g)����H����91.5 kJ/mol
Cl2(g)===HCl(g)����H����91.5 kJ/mol
D��2HCl(g)===H2(g)��Cl2(g)����H����183 kJ/mol
 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д� Ӧ����㲦ϵ�д�
Ӧ����㲦ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ͼ��ʾ��װ�ã����������в�����������ʱ������˵����ȷ����
(����)
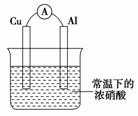
A��Cu��ԭ��صĸ���
B��Al��ԭ��صĸ���
C��������Al�ص�������ͭ
D����Ƭ�ϵĵ缫��ӦʽΪ��Al��3e��===Al3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
100 mLŨ��Ϊ2 mol��L-1�������������пƬ��Ӧ��Ϊ�ӿ췴Ӧ���ʣ��ֲ�Ӱ�������������������ɲ��õķ����ǣ� ��
A.��������6 mol��L-1������ B.�������������ƹ���
C.���� D.��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ���ǣ� ����
A���������dz��õľ�ˮ�����Ʋⷲ������Ԫ�ص����ʶ��о�ˮ����
B����ͬ���ʸ��������ԣ�������������ˮ����Al2(SO4)3�Ͳ�һ���о�ˮ����
C����ˮ������ָ��ɱ��ˮ��ϸ�����к�����Ļ�ѧ�Լ�
D����������˵�����κ����ζ���������ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ʵ�ˮ��Һ�ܵ��磬�Ҹ������Ƿǵ���ʣ�����ˮʱ��ѧ�����ƻ�����(����)
A��Һ�塡���������� B���ɱ�
C������ D�����ᱵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ڿ��淴ӦA(g)��2B(g)2C(g)(����ӦΪ���ȷ�Ӧ)������ͼ������ȷ����(����)

A����������������B.

C����������������D.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�״�(CH3OH)��һ����Ҫ�Ļ���ԭ�ϣ��ϳɼ״�����Ҫ��ӦΪ��
CO(g)��2H2(g)CH3OH(g)����H��0��
��.��һ�������£�������Ӧ��һ�ܱ������дﵽƽ�⡣
(1)�������������£����д�ʩ�п����������CO��ת���ʵ���__________(����ĸ)��
A�������¶ȡ��������� B������ѹǿ
C��ͨ��CO D��ͨ��H2
(2)�ڱ�֤H2Ũ�Ȳ��������£����������������ƽ��__________(����ĸ)��
A��������Ӧ�����ƶ�
B�����淴Ӧ�����ƶ�
C�����ƶ�
�������жϵ�������__________________________��
��.ԭ�����ļӹ������г�������һ����CO2��Ϊ���о���ͬ�¶���CO2�Ը÷�Ӧ��Ӱ�죬��CO2��CO��H2�Ļ������Ϊԭ����һ�������½���ʵ�飬���������ԭ��������ֺ�����ͬʱ����Ӧ���ɼ״�����������̼ת�����Dz���ͬ�ġ�ʵ�����ݼ��±���
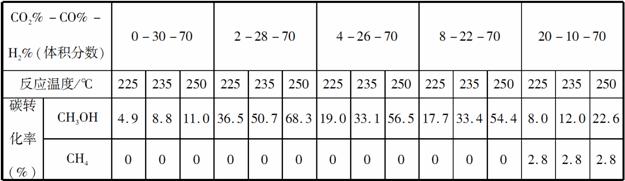
(3)���ϱ����ݿɵó�������ۡ�
����һ����һ�������£���Ӧ�¶�Խ�ߣ�̼ת����__________ _______________________________________________��
���۶���_______________________________________________ _____________________________________________________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪�����Ȼ�ѧ����ʽ��
��CH3COOH(l)��2O2(g)===2CO2(g)��2H2O(l)
��H1����870.3 kJ/mol
��C(s)��O2(g)===CO2(g)����H2����393.5 kJ/mol
��H2(g)�� O2(g)===H2O(l)����H3����285.8 kJ/mol
O2(g)===H2O(l)����H3����285.8 kJ/mol
��Ӧ��2C(s)��2H2(g)��O2(g)===CH3COOH(l)���ʱ�Ϊ(����)
A��488.3 kJ/mol�������� B����224.15 kJ/mol
C����488.3 kJ/mol D��244.15 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ�����������������Ⱦ�������·�Ӧ��
CH4(g)��2NO2(g) N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g) 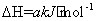
���¶�T1��T2ʱ���ֱ�0.50molCH4��1.2molNO2�������Ϊ1L�ĺ����ܱ������У����n��N2����ʱ��仯���������±���
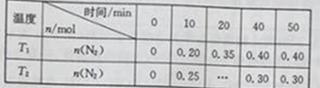
����˵������ȷ����
A. 10 min�ڣ�T1ʱ��v��N2����T2ʱ��С
min�ڣ�T1ʱ��v��N2����T2ʱ��С
B. T1<T2
C. a<0
D. T2ʱ������ƽ�����������ٳ���1.2molCH4�����´ﵽƽ��ʱn��N2��=0.40mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com