
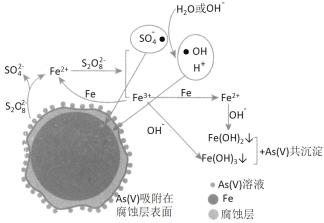
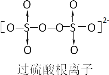
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(过硫酸根离子如图所示)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为NA,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是
A.室温下,中间产物 Fe(OH)3 溶于水所得饱和溶液中 c(Fe3+)为2.7×10-18 mol·L-1
B.若 56g Fe 参加反应,共有 NA 个 S2O82- 被还原
C.1mol 过硫酸钠(Na2S2O8)含 2NA 个过氧键
D.pH 越小,越有利于去除废水中的正五价砷
【答案】A
【解析】
A.已知Ksp[Fe(OH)3]=2.7×10-39,此溶液碱性极弱,溶液的pH接近7,即c(OH-)=10-7mol/L,代入方程即可解得:c(Fe3+)=2.7×10-18molL-1,故A正确;
B.56g Fe为1mol,根据图示,一个S2O82-和一个Fe反应生成两个SO42-和一个Fe2+,该过程转移2个电子,但是Fe2+还要与S2O82-反应变成Fe3+和自由基(SO4-●),因此1mol铁参加反应要消耗1.5molS2O82-,共有1.5NA个S2O82-被还原,故B错误;
C.根据Na2S2O8的结构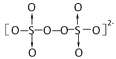 ,1mol过硫酸钠(Na2S2O8)含1mol过氧键,即含有NA个过氧键,故C错误;
,1mol过硫酸钠(Na2S2O8)含1mol过氧键,即含有NA个过氧键,故C错误;
D.根据图示,最后是将铁离子和亚铁离子转变为沉淀,与正五价砷共沉淀析出,则溶液的碱性越强,越有利于沉淀析出,即pH越大,越有利于去除废水中的正五价砷,故D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,⑦(NH4)2SO4,⑧乙醇中,由极性键形成的非极性分子有_______(填序号,以下同),含有金属离子的物质是__,分子间可形成氢键的物质是________,属于离子晶体的是__,属于原子晶体的是__,①~⑤五种物质的熔点由高到低的顺序是__。
(2)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__。
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.__;B.__;C.__D.____。
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里 Ca2+的浓度一般采用mg/cm3 来表示。抽取一定体积的血样加适量的草酸钱[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液与之反应即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:

(实验探究一 : 配制酸性KMnO4标准溶液)如图是配制l00mL酸性KMnO4标准溶液的过程示意图 :
(1)请你观察图示判断其中不正确的操作有________________(填序号)。
(2)配置上述溶液,需要使用的玻璃仪器是量筒、烧杯、玻璃棒、_______________(填名称)。
(3)按照图示的操作配制溶液,所得KMnO4标准溶液的浓度将________________(填 偏大 或 偏小 或者 无影响,下同)。如未冷却至室温就进行液体转移,则其所配的氯化钾溶液的浓度_____;若用托盘天平时错把砝码放在左边,把药品放在右边称量,则其所配氯化钾溶液的浓度_______。
(实验探究二:测定血液样品中Ca2+的浓度)抽取血样20.00mL经过上述处理后得到草酸,再用0.020mol/L酸性KMnO4溶液与之反应,使草酸转化成CO2 逸出,这时共消耗12.00mL酸性KMnO4溶液 。
(4)已知草酸跟酸性KMnO4溶液反应的离子方程式为 :2MnO4-+5H2C2O4+6 H+ =2Mnx++l0CO2↑+8H2O 则式中的x=_______。
(5)经过计算,血液样品中Ca2+的浓度为____mg/mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图像的解释或结论不正确的是

A. 由甲可知:使用催化剂不影响反应热
B. 由乙可知:对于恒温恒容条件下的反应2NO2 (g)![]() N2O4(g),A点为平衡状态
N2O4(g),A点为平衡状态
C. 由丙可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
D. 由丁可知:将T1 ℃ 的A、B饱和溶液升温至T2 ℃时,A与B溶液的质量分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
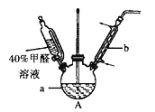
(1)在如图装置中进行实验,向a中加入0.5 mol/LCuSO4溶液50 mL和5 mol/LNaOH溶液100 mL,振荡,再加入40%的甲醛溶液50 mL,缓慢加热a,在65 ℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红褐色,并有气体产生。
①仪器b的名称是_________,作用为_________。
②能说明甲醛具有还原性的实验现象是______________。
(2)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应):
已知:Cu2O ![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
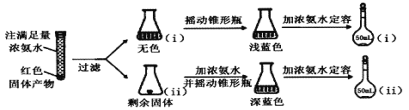
①摇动锥形瓶i的目的是_______。
②锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为_______。
③将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类和氧化还原的描述正确的是( )
A.酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系
B.元素的单质可由氧化或还原含该元素的化合物来制得
C.得电子越多的氧化剂,其氧化性就越强;含最高价元素的化合物一定具有强的氧化性
D.烧碱、熟石灰均属于碱,酸、碱、盐之间发生的反应均属于复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的四个装置图判断下列说法错误的是( )

A. 可以用图甲装置来证明非金属性:S>C>Si
B. 可以用图乙装置来检验是否有还原性气体生成
C. 可以用图丙装置来制备并用向上排空气法收集氨气
D. 可以用图丁装置来演示Cl2的喷泉实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,互为同位素的是_____,互为同素异形体的是_____,互为同系物的是_____,互为同分异构体的是_____,属于同一种物质的是_____。
①金刚石与石墨 ②12C与14C ③O2与O3 ④ ⑤
⑤ ⑥
⑥ 与
与 ⑦CH2=CHCH2OH与CH3COCH3 ⑧
⑦CH2=CHCH2OH与CH3COCH3 ⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com