
【题目】根据下面的四个装置图判断下列说法错误的是( )

A. 可以用图甲装置来证明非金属性:S>C>Si
B. 可以用图乙装置来检验是否有还原性气体生成
C. 可以用图丙装置来制备并用向上排空气法收集氨气
D. 可以用图丁装置来演示Cl2的喷泉实验
【答案】C
【解析】
A项、元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,稀硫酸和碳酸钠反应生成二氧化碳,二氧化碳、水和硅酸钠反应生成胶状物质硅酸,由此得出酸性:硫酸>碳酸>硅酸,则非金属性S>C>Si,故A正确;
B项、蔗糖在浓硫酸的作用下脱水炭化生成碳,碳与浓硫酸在加热条件下反应生成二氧化硫、二氧化碳和水,二氧化硫具有还原性,能与酸性高锰酸钾溶液发生氧化还原反应,使酸性高锰酸钾溶液褪色,故B正确;
C项、氨气的密度比空气小,应用向下排空气法收集,故C错误;
D项、氯气能与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,使烧瓶内气体压强小于外界大气压而产生喷泉,故D正确;
故选C。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是___。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为:NH3+Cl2—N2+HCl
①该反应中被氧化的元素是___(填元素名称),氧化剂是___(填化学式)。
②配平该方程式:__NH3+__Cl2—__N2+__HCl
③根据上述反应,工业生产中常用喷洒氨水的方法来检查是否有Cl2泄漏,若Cl2有泄漏,可以观察到的现象是___,产生该现象的反应方程式为___。
(3)“地康法”制氯气的反应原理图示如下:

①反应I的化学方程式为___。
②反应II属于___反应。(填四种基本反应类型之一)。
③若要制得a个氯气分子,则整个反应中转移电子的个数为___个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废液中含有 大量 的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴,(Br2常温下是深红棕色液体),设计了如下的流程图:

可供选择的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2 溶液(H+)、KMnO4溶液(H+)、盐酸。请根据流程图回答相关问题 :
(1)若试剂a为H2O2溶液(H+),已知H2O2+2KBr+2HCl=Br2+2H2O+2KCl,
①发生反应的离子方程式为:___________。
②每消耗0.2mol H2O2,反应转移的电子数为_______mol。
③还原剂和还原产物的物质的量之比是_____________。
(2)操作①②③④⑤对应的名称分别是:萃取、_________、蒸馏、过滤、__________。蒸馏过程用到下图装置的名称是A____________ B____________。

(3)为了除去无色液体中的Ca2+、Mg2+、SO42-,从可供选则试剂中选择试剂b所代表的物质,按照滴加的顺序依次是_______、_________、_________(填化学式)。
(4)调节pH=7是为了除去杂质离子_______和________,以提高氯化钾晶体的纯度。
查看答案和解析>>
科目:高中化学 来源: 题型:
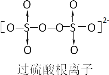
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(过硫酸根离子如图所示)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为NA,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是
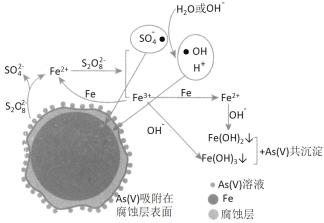
A.室温下,中间产物 Fe(OH)3 溶于水所得饱和溶液中 c(Fe3+)为2.7×10-18 mol·L-1
B.若 56g Fe 参加反应,共有 NA 个 S2O82- 被还原
C.1mol 过硫酸钠(Na2S2O8)含 2NA 个过氧键
D.pH 越小,越有利于去除废水中的正五价砷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置进行有关Cl2的实验。下列说法不正确的是( )
A.  图中:实验现象证明氯气无漂白作用,氯水有漂白作用
图中:实验现象证明氯气无漂白作用,氯水有漂白作用
B.  图中:收集氯气
图中:收集氯气
C.  图中:生成棕黄色的烟,加少量水溶解得到蓝绿色溶液
图中:生成棕黄色的烟,加少量水溶解得到蓝绿色溶液
D.  图中:若气球干瘪,证明可与NaOH溶液反应
图中:若气球干瘪,证明可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32﹣+O2+xOH﹣═Fe3O4+S4O62﹣+2H2O,下列说法错误的是( )
A. 每生成1mol Fe3O4,反应转移的电子总数为4NA
B. Fe2+和S2O32﹣都是还原剂
C. 1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为![]() mol
mol
D. x=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是硫酸试剂瓶标签上的内容:

(1)某化学兴趣小组进行硫酸性质的实验探究时,需要490mL 4.6mol·L-1的稀硫酸,现要配制该浓度的溶液所需的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要__________(填仪器名称);需要量取98%浓硫酸____________mL进行配制;
(2)配制溶液时有如下操作:a.稀释溶解b.摇匀c.洗涤d.冷却e.量取f.将溶液移至容量瓶g.定容,实验操作顺序正确的是(___________)。
A. e→a→f→d→c→f→g→b B. e→a→d→f→c→f→g→b
C. e→a→f→d→c→f→b→g D. e→a→d→f→c→f→b→g
(3)下列为配制过程中部分操作的示意图,其中有错误的是____(填序号);

(4)在配制4.6mol·L-1稀硫酸的过程中,下列情况会引起配制所得的硫酸溶液物质的量浓度偏高的是___;
A.未经冷却趁热将溶液注入容量瓶中 B.容量瓶洗涤后,未干燥处理
C.定容时仰视观察液面 D.未洗涤烧杯和玻璃棒
(5)为中和100mL 2.3 mol·L-1KOH溶液后显中性,需要加入________mL 4.6mol·L-1稀硫酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M为+2价金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能将工业废气(SO2)高效地还原成无公害的固体单质硫,防止环境污染。其流程为: MFe2Ox![]() MFe2Oy。则下列判断正确的是( )
MFe2Oy。则下列判断正确的是( )
A.MFe2Ox作催化剂B.SO2是该反应的还原剂
C.x<yD.SO2发生了置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
A.22.4L水含原子数为NAB.18克水含水分子为NA
C.0.5摩尔H2SO4含质子数2.5 NAD.1摩尔CO32- 含电子数30NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com