
【题目】某废液中含有 大量 的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴,(Br2常温下是深红棕色液体),设计了如下的流程图:

可供选择的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2 溶液(H+)、KMnO4溶液(H+)、盐酸。请根据流程图回答相关问题 :
(1)若试剂a为H2O2溶液(H+),已知H2O2+2KBr+2HCl=Br2+2H2O+2KCl,
①发生反应的离子方程式为:___________。
②每消耗0.2mol H2O2,反应转移的电子数为_______mol。
③还原剂和还原产物的物质的量之比是_____________。
(2)操作①②③④⑤对应的名称分别是:萃取、_________、蒸馏、过滤、__________。蒸馏过程用到下图装置的名称是A____________ B____________。

(3)为了除去无色液体中的Ca2+、Mg2+、SO42-,从可供选则试剂中选择试剂b所代表的物质,按照滴加的顺序依次是_______、_________、_________(填化学式)。
(4)调节pH=7是为了除去杂质离子_______和________,以提高氯化钾晶体的纯度。
【答案】H2O2+2Br-+2H+=Br2 ↑+2H2O 0.4 2:1 分液 蒸发结晶 具支烧瓶 冷凝管 BaCl2 KOH K2CO3 OH- CO32-
【解析】
根据图示可知,制备流程为:废液中加入双氧水,将溴离子氧化成溴单质,然后加入四氯化碳后通过萃取、分液分离出溴,通过操作③蒸馏得到四氯化碳和溴单质;无色液体Ⅰ中含有K+、Cl-、Ca2+、Mg2+、SO42-,分别加入BaCl2、K2CO3、KOH溶液过滤后得到无色溶液Ⅱ和固体A,再调节溶液Ⅱ的pH萃取碳酸根离子、氢氧根离子,得到无色溶液Ⅲ,最后通过蒸发结晶获得氯化钾固体;
(1)根据化学方程式H2O2+2KBr+2HCl=Br2+2H2O+2KCl写出离子方程式;找到过氧化氢和转移的电子数之间的关系,找出还原剂和还原产物的物质的量之比;
(2)加入CCl4的目的是萃取;紧接着萃取后的操作是将有机层与水层分开,叫做分液;从含有溴的CCl4溶液中分离得到CCl4和液溴的操作,是将两种相互混溶的液体进行分离的操作,叫做蒸馏;操作④完成后得到固体A和无色液体I,分离固体和液体的操作是过滤;操作⑤是从溶液中得到能溶解于水的氯化钾晶体,是蒸发结晶;
(3)除去Ca2+,选用饱和K2CO3溶液;除去Mg2+,选用KOH溶液;除去SO42-,选用BaCl2溶液;
(4)无色液体Ⅱ中还含有杂质离子CO32-和OH-;用pH试纸测定至pH=7。
制备流程为:废液中加入双氧水,将溴离子氧化成溴单质,然后加入四氯化碳后通过萃取、分液分离出溴,通过操作③蒸馏得到四氯化碳和溴单质;无色液体Ⅰ中含有K+、Cl、Ca2+、Mg2+、SO42,分别加入BaCl2、K2CO3、KOH溶液过滤后得到无色溶液Ⅱ和固体A,再调节溶液Ⅱ的pH萃取碳酸根离子、氢氧根离子,得到无色溶液Ⅲ,最后通过蒸发结晶获得氯化钾固体;
(1)由加入的CCl4及得到的深红棕色液体知,试剂a能将Br氧化为Br2,试剂a应具有氧化性,所以应选用H2O2溶液,离子方程式为H2O2 +2Br-+2H+=Br2 ↑+2H2O,H2O2中氧的化合价从-1到-2,氧原子个数为2,全部降低,故1mol H2O2 发生反应时转移的电子数2mol,每消耗0.2mol H2O2 转移电子的物质的量为0.4mol;还原剂是溴化氢,还原产物为水,它们的物质的量之比为2:1;
(2)由流程图知,无色液体Ⅰ中含有K+、Cl、Ca2+、Mg2+、SO42,无色液体Ⅲ中只含有K+、Cl,则试剂b的作用是除去Ca2+、Mg2+、SO42;操作①是萃取,操作②是将互不相溶的两种液体分开,为分液操作,操作③是将沸点不同、互溶的两液体分开,为蒸馏操作,操作④是将溶液与沉淀分开,为过滤操作,操作⑤是将KCl从其水溶液中提取出来,为蒸发结晶操作,操作①、②、③、④、⑤的名称是:萃取、分液、蒸馏、过滤、蒸发结晶,蒸馏过程A为具支试管,B为冷凝管;
(3)由于除杂时除杂试剂需过量,且不能引入新杂质,所以除去Ca2+,选用饱和K2CO3溶液;除去Mg2+,选用KOH溶液;除去SO42,选用BaCl2溶液。要除去过量的BaCl2,要满足BaCl2溶液在饱和K2CO3溶液之前加入即可;
(4)由以上知,无色液体Ⅱ中还含有杂质离子CO32和OH,需用盐酸来除去过量的OH及CO32,调节pH=7的操作方法是滴加盐酸,无气体产生时,用pH试纸测定至pH=7。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】(1)已知:25 ℃、101 kPa时,C(s)+1/2O2(g)=CO(g) ΔH1=-110.5 kJ/mol
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
试回答下列问题:
①碳的燃烧热是:__________(填“ΔH1”或“ΔH2”);
②CO(g)+1/2O2(g)=CO2(g) ΔH=__________kJ/mol。
(2)在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g)![]() N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
①5秒内,v(NO2)=__________mol/(L·s);
②若将该容器置于冰水中,气体颜色将________(填“变深”“变浅”或“不变”);
③该反应的平衡常数表达式K=________________。
(3)NaHSO3是中学化学常见的物质。HSO3-在水溶液中存在如下两个平衡:
HSO3-=H++SO32- Ka2
HSO3-+H2O=H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2,则0.1 mol/L NaHSO3溶液:
①溶液呈__________(填“酸性”“碱性”或“中性”);
②溶液中c(Na+)______c(HSO3-)(填“>”“<”或“=”)。
(4)将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。

①几分钟后,可观察到导管中的水柱________;
A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的________;
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中既是化合反应又是氧化还原反应的是
A.CaO + H2O = Ca(OH)2B.Ca + Cl2![]() CaCl2
CaCl2
C.Fe + CuSO4 = FeSO4 + CuD.H2SO4 + BaCl2 = BaSO4 ↓+ 2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里 Ca2+的浓度一般采用mg/cm3 来表示。抽取一定体积的血样加适量的草酸钱[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液与之反应即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:

(实验探究一 : 配制酸性KMnO4标准溶液)如图是配制l00mL酸性KMnO4标准溶液的过程示意图 :
(1)请你观察图示判断其中不正确的操作有________________(填序号)。
(2)配置上述溶液,需要使用的玻璃仪器是量筒、烧杯、玻璃棒、_______________(填名称)。
(3)按照图示的操作配制溶液,所得KMnO4标准溶液的浓度将________________(填 偏大 或 偏小 或者 无影响,下同)。如未冷却至室温就进行液体转移,则其所配的氯化钾溶液的浓度_____;若用托盘天平时错把砝码放在左边,把药品放在右边称量,则其所配氯化钾溶液的浓度_______。
(实验探究二:测定血液样品中Ca2+的浓度)抽取血样20.00mL经过上述处理后得到草酸,再用0.020mol/L酸性KMnO4溶液与之反应,使草酸转化成CO2 逸出,这时共消耗12.00mL酸性KMnO4溶液 。
(4)已知草酸跟酸性KMnO4溶液反应的离子方程式为 :2MnO4-+5H2C2O4+6 H+ =2Mnx++l0CO2↑+8H2O 则式中的x=_______。
(5)经过计算,血液样品中Ca2+的浓度为____mg/mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
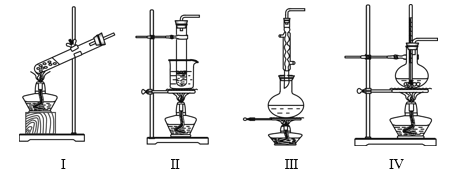
选项 | 实验目的 | 反应试剂及所需物质 | 选择装置 |
A | 制乙酸乙酯 | 无水乙醇、冰醋酸、浓硫酸、碎瓷片 | Ⅰ |
B | 进行银镜实验 | 银氨溶液、乙醛 | Ⅱ |
C | 制葡萄糖酸 | 葡萄糖、3%溴水 | Ⅲ |
D | 制乙烯 | 无水乙醇、浓硫酸、碎瓷片 | Ⅳ |
[注:葡萄糖与3%溴水在55 ℃左右反应]
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图像的解释或结论不正确的是

A. 由甲可知:使用催化剂不影响反应热
B. 由乙可知:对于恒温恒容条件下的反应2NO2 (g)![]() N2O4(g),A点为平衡状态
N2O4(g),A点为平衡状态
C. 由丙可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
D. 由丁可知:将T1 ℃ 的A、B饱和溶液升温至T2 ℃时,A与B溶液的质量分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
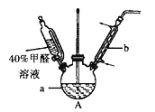
(1)在如图装置中进行实验,向a中加入0.5 mol/LCuSO4溶液50 mL和5 mol/LNaOH溶液100 mL,振荡,再加入40%的甲醛溶液50 mL,缓慢加热a,在65 ℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红褐色,并有气体产生。
①仪器b的名称是_________,作用为_________。
②能说明甲醛具有还原性的实验现象是______________。
(2)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应):
已知:Cu2O ![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
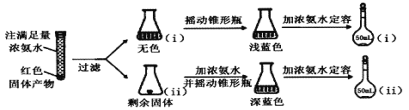
①摇动锥形瓶i的目的是_______。
②锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为_______。
③将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的四个装置图判断下列说法错误的是( )

A. 可以用图甲装置来证明非金属性:S>C>Si
B. 可以用图乙装置来检验是否有还原性气体生成
C. 可以用图丙装置来制备并用向上排空气法收集氨气
D. 可以用图丁装置来演示Cl2的喷泉实验
查看答案和解析>>
科目:高中化学 来源: 题型:
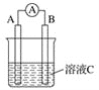
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为___________,A电极的电极反应式为_______;反应进行一段时间后溶液C的pH将___ (填“升高”“降低”或“基本不变”)。
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是____,负极反应为___________;正极反应为_____________________________。
(3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为___________,电池总反应式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com