
【题目】氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是___。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为:NH3+Cl2—N2+HCl
①该反应中被氧化的元素是___(填元素名称),氧化剂是___(填化学式)。
②配平该方程式:__NH3+__Cl2—__N2+__HCl
③根据上述反应,工业生产中常用喷洒氨水的方法来检查是否有Cl2泄漏,若Cl2有泄漏,可以观察到的现象是___,产生该现象的反应方程式为___。
(3)“地康法”制氯气的反应原理图示如下:

①反应I的化学方程式为___。
②反应II属于___反应。(填四种基本反应类型之一)。
③若要制得a个氯气分子,则整个反应中转移电子的个数为___个。
【答案】a 氮 Cl2 2 3 1 6 有白烟产生 HCl+NH3=NH4Cl 2HCl+CuO=CuCl2+H2O 置换反应 2a
【解析】
(1)反应前后有元素化合价变化的是氧化还原反应,没有化合价变化的是非氧化还原反应;
(2)①NH3和Cl2反应中氮元素化合价由-3价升高为0,氯元素化合价由0降低为-1价;
②根据得失电子守恒配平方程式;
③氨气与氯化氢反应有白烟氯化铵生成;
(3)①根据反应原理图,反应I是HCl、CuO反应生成CuCl2和H2O;
②反应II是CuCl2与氧气反应生成氧化铜和氯气;
③反应I是非氧化还原反应,反应II是氧化还原反应,根据2CuCl2+O2=2CuO+2Cl2确定转移电子数。
(1)a. 滴水成冰,没有生成新物质,属于物理变化,a符合;
b. 蜡炬燃烧生成二氧化碳和水,碳元素、氧元素化合价改变,属于氧化还原反应,b不符合;
c. 百炼成钢,碳与氧气反应生成二氧化碳,碳元素、氧元素化合价改变,属于氧化还原反应,c不符合;
故答案为:a;
(2)①NH3和Cl2的反应中N元素化合价由3价升高为0,氯元素化合价由0降低为1价,则该反应中被氧化的元素是氮元素,氧化剂是Cl2;
故答案为:氮;Cl2;
②氮元素化合价由3价升高为0,化合价升高3价,氯元素化合价由0降低为1价,化合价降低1价,根据得失电子守恒配平方程式为:2NH3+3Cl2=N2+6HCl;
故答案为:2;3;1;6;
③氨气与氯化氢反应生成氯化铵,所以会有白烟生成,产生该现象的反应方程式为:HCl+NH3=NH4Cl;
故答案为:有白烟产生;HCl+NH3=NH4Cl;
(3)①根据反应原理图,反应I是HCl、CuO反应生成CuCl2和H2O,反应方程式是:2HCl+CuO=CuCl2+H2O;
故答案为:2HCl+CuO=CuCl2+H2O;
②反应II是CuCl2与氧气反应生成氧化铜和氯气,反应方程式是2CuCl2+O2=2CuO+2Cl2,属于置换反应;
故答案为:置换反应;
③反应I是非氧化还原反应,反应II是氧化还原反应,根据2CuCl2+O2=2CuO+2Cl2,可知氯元素化合价由1升高为0,若要制得a个氯气分子则整个反应中转移电子的个数为2a个;
故答案为:2a。


科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0Lwmol·L-1CH3COOH溶液与0.1molNaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图所示。下列叙述正确的是( )
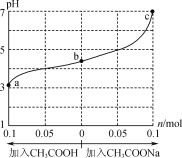
A.b点溶液中:c(Na+)<c(CH3COOH)+c(CH3COO-)
B.由b点到a点的过程中,c(Na+)有可能大于c(CH3COO-)
C.a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
D.25℃时,Ka(CH3COOH)=![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:25 ℃、101 kPa时,C(s)+1/2O2(g)=CO(g) ΔH1=-110.5 kJ/mol
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
试回答下列问题:
①碳的燃烧热是:__________(填“ΔH1”或“ΔH2”);
②CO(g)+1/2O2(g)=CO2(g) ΔH=__________kJ/mol。
(2)在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g)![]() N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
①5秒内,v(NO2)=__________mol/(L·s);
②若将该容器置于冰水中,气体颜色将________(填“变深”“变浅”或“不变”);
③该反应的平衡常数表达式K=________________。
(3)NaHSO3是中学化学常见的物质。HSO3-在水溶液中存在如下两个平衡:
HSO3-=H++SO32- Ka2
HSO3-+H2O=H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2,则0.1 mol/L NaHSO3溶液:
①溶液呈__________(填“酸性”“碱性”或“中性”);
②溶液中c(Na+)______c(HSO3-)(填“>”“<”或“=”)。
(4)将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。

①几分钟后,可观察到导管中的水柱________;
A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的________;
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,⑦(NH4)2SO4,⑧乙醇中,由极性键形成的非极性分子有_______(填序号,以下同),含有金属离子的物质是__,分子间可形成氢键的物质是________,属于离子晶体的是__,属于原子晶体的是__,①~⑤五种物质的熔点由高到低的顺序是__。
(2)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__。
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.__;B.__;C.__D.____。
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向BaCl2溶液中通入SO2和气体X,出现白色沉淀 | 气体X一定作氧化剂 |
B | NaHCO3溶液与NaAlO2溶液混合,立即产生白色沉淀 | 结合H+的能力:AlO2->CO32- |
C | 向盛有Cu2O的试管中加入足量稀硫酸,溶液变为蓝色,试管底有红色沉淀 | 氧化性:H+>Cu2+ |
D | 向2支盛有2mL0.1mol/LNaOH溶液的试管中分别滴入2滴0.1mol/LAlCl3、MgCl2溶液,振荡,前者无沉淀,后者有白色沉淀 | Ksp[Al(OH)3]>Ksp[Mg(OH)2] |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 mL 0.3 mol·L-1 Na2SO4溶液和50 mL 0.2 mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为( )
A. 0.20 mol·L-1B. 0.25 mol·L-1
C. 0.40 mol·L-1D. 0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中既是化合反应又是氧化还原反应的是
A.CaO + H2O = Ca(OH)2B.Ca + Cl2![]() CaCl2
CaCl2
C.Fe + CuSO4 = FeSO4 + CuD.H2SO4 + BaCl2 = BaSO4 ↓+ 2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里 Ca2+的浓度一般采用mg/cm3 来表示。抽取一定体积的血样加适量的草酸钱[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液与之反应即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:

(实验探究一 : 配制酸性KMnO4标准溶液)如图是配制l00mL酸性KMnO4标准溶液的过程示意图 :
(1)请你观察图示判断其中不正确的操作有________________(填序号)。
(2)配置上述溶液,需要使用的玻璃仪器是量筒、烧杯、玻璃棒、_______________(填名称)。
(3)按照图示的操作配制溶液,所得KMnO4标准溶液的浓度将________________(填 偏大 或 偏小 或者 无影响,下同)。如未冷却至室温就进行液体转移,则其所配的氯化钾溶液的浓度_____;若用托盘天平时错把砝码放在左边,把药品放在右边称量,则其所配氯化钾溶液的浓度_______。
(实验探究二:测定血液样品中Ca2+的浓度)抽取血样20.00mL经过上述处理后得到草酸,再用0.020mol/L酸性KMnO4溶液与之反应,使草酸转化成CO2 逸出,这时共消耗12.00mL酸性KMnO4溶液 。
(4)已知草酸跟酸性KMnO4溶液反应的离子方程式为 :2MnO4-+5H2C2O4+6 H+ =2Mnx++l0CO2↑+8H2O 则式中的x=_______。
(5)经过计算,血液样品中Ca2+的浓度为____mg/mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的四个装置图判断下列说法错误的是( )

A. 可以用图甲装置来证明非金属性:S>C>Si
B. 可以用图乙装置来检验是否有还原性气体生成
C. 可以用图丙装置来制备并用向上排空气法收集氨气
D. 可以用图丁装置来演示Cl2的喷泉实验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com