
100g无水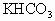 与
与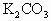 的混合物,在加热至质量恒定时,产生13.2g
的混合物,在加热至质量恒定时,产生13.2g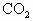 ,则混合物中
,则混合物中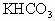 的质量分数是
的质量分数是
[ ]
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 三氯甲基苯基甲醇 | 无色液体.不溶于水,溶于乙醇. |
| 醋酸酐 | 无色液体.溶于水形成乙酸,溶于乙醇. |
| 结晶玫瑰 | 白色至微黄色晶体.不溶于水,溶于乙醇.熔点:88℃ |
| 醋酸 | 无色的吸湿性液体,易溶于水、乙醇. |
| 加料 |
| 加热3小时,控制 |
| 温度在110℃ |
| 反应液倒 |
| 入冰水中 |
| 抽滤 |
| 重结晶 |

| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 100 |
| a |
| 100 |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:
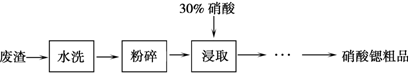
| 温度/℃物质 | 0 | 20 | 30 | 45 | 60 | 80 |
| Sr(NO3)2 | 28.2 | 40.7 | 47 | 47.2 | 48.3 | 49.2 |
| Ca(NO3)2?4H2O | 102 | 129 | 152 | 230 | 300 | 358 |
| O | 2- 3 |
| O | 2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 假 设 | 实验方案 | 实验结论 | |
| 甲同学 | 酸性: H2CO3>C6H5OH |
取少量苯酚放入试管,加过量NaOH溶液得澄清溶液,冷却至室温,再通入一段时间CO2,冷却至室温,观察未出现浑浊 | 通入CO2未见浑浊说明CO2不能与C6H5ONa反应,假设错误 |
| 乙同学 | 酸性: C6H5OH>HCO3- |
方案(一):在苯酚的乳浊液中加一定量的Na2CO3固体,Na2CO3固体溶解,苯酚乳浊液变清,无气泡生成.放置冷却,再观察,混合物仍然澄清. 方案(二):在苯酚的乳浊液中加一定量的饱和Na2CO3溶液,乳浊液变清,无气泡生成. |
方案一结论:假设正确 方案二结论:假设正确 |
| 提出假设 | 实验方案和预测现象 |
| ① |
② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
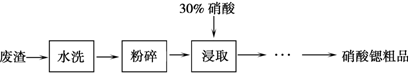
| 温度/℃物质 | 0 | 20 | 30 | 45 | 60 | 80 |
| Sr(NO3)2 | 28.2 | 40.7 | 47 | 47.2 | 48.3 | 49.2 |
| Ca(NO3)2?4H2O | 102 | 129 | 152 | 230 | 300 | 358 |
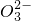 ═SrCO3↓ Ba2++C
═SrCO3↓ Ba2++C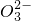 ═BaCO3↓
═BaCO3↓查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com