
【题目】下列除去杂质的方法正确的是
物质 | 杂质 | 试剂 | 主要操作 | |
A | NaHCO3 | Na2CO3 | ---- | 灼烧 |
B | SiO2 | Fe2O3 | 盐酸 | 过滤 |
C | KBr溶液 | Br2 | KOH溶液 | 分液 |
D | Cl2 | HCl | 饱和碳酸钠溶液 | 洗气 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】下图是A、B两种重要的有机合成原料的结构。下列有关说法中正确的是
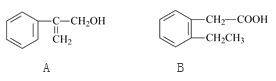
A. A与B互为同系物
B. A与B都能与溴的四氯化碳溶液发生加成反应
C. 在一定条件下,A与B均能发生取代反应
D. A与B都能与NaHCO3溶液反应产生CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.道尔顿提出原子学说
B.侯德榜发明了“侯氏制碱法”,改进了碳酸钠的制取工艺
C.舍勒首次制得金属钠
D.门捷列夫提出元素周期表
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:mA(g)+nB(?)![]() xC(g) △H,在不同温度及压强(p1,p2)条件下,反应物A的转化率如图所示,下列判断正确的是
xC(g) △H,在不同温度及压强(p1,p2)条件下,反应物A的转化率如图所示,下列判断正确的是
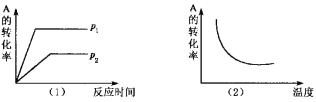
A. △H >0,m+n>x,同时B为非气态
B. △H >0,m+n<x,同时B为气态
C. △H <0,m+n>x,同时B为气态
D. △H <0,m<x,同时B为非气态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物存在如下转化关系:
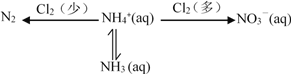
(1)在氨氮废水中通入一定量的氯气,利用产生的HClO可除去废水中含有的游离氨或铵盐。
已知 NH4+ + HClO ![]() NH2Cl + H+ + H2O H = a kJmol-1
NH2Cl + H+ + H2O H = a kJmol-1
2NH2Cl + HClO ![]() N2 + H2O + 3H+ + 3Cl- H = b kJmol-1
N2 + H2O + 3H+ + 3Cl- H = b kJmol-1
则 2NH4+ + 3HClO ![]() N2 + 3H2O + 5H+ + 3Cl- H =______kJmol-1
N2 + 3H2O + 5H+ + 3Cl- H =______kJmol-1
(2)电解法也可除去水中的氨氮,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性混合溶液来模拟。
① 电解时,阳极的电极反应式为________。
② 电解过程中,溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示。

图1 Cl-浓度对氨氮去除速率、能耗的影响 图2初始pH对氨氮去除速率、能耗的影响
图1中当Cl-浓度较低时、图2中当初始pH达到12时,均出现氨氮去除速率低而能耗高的现象,共同原因是________;图2中,pH为6时处理效果最佳,当pH过低时,处理效果不佳的原因可能是________。
③ 当溶液中Cl-浓度较高时,测得溶液中的NO![]() 浓度会随之增大,可能的原因是________。
浓度会随之增大,可能的原因是________。
(3)某工厂将含NH4+废水的去除与工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分)的去除结合起来,设计了如下方案:
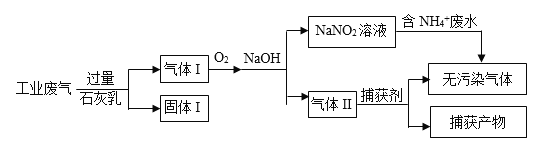
① 固体I的成分为________。
② 为使100L 150 mg/L(浓度均以氮原子计,下同)的含NH4+ 废水达到国家二级排放标准10mg/L,图中通入的氧气在标准状况下的体积至少为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用材料
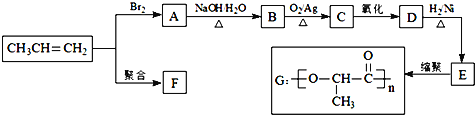
(1)E中官能团的名称_________.
(2)写出D的结构简式_________.
(3)聚合物F的结构简式是____________________.
(4)B转化为C的化学方程式是______________________________.
(5)在一定条件下,两分子E能脱去两分子水形成一种六元环化合物,该化合物的结构简式是_________.
(6)E有多种同分异构体,写出与E含有相同官能团的同分异构体的结构简式_________,其核磁共振氢谱显示为__________组峰,峰面积之比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表1是常温下几种弱酸的电离常数(K),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1几种弱酸的电离常数(25℃)
酸 | 电离常数(K) |
CH3COOH | 1.8×10-5 |
HNO2 | 5.1×10-4 |
HCN | 6.2×10-10 |
HClO | 3×10-8 |
表2几种难溶电解质的溶度积(25℃)
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1.1×10-10 |
MgCO3 | 6.8×10-6 |
CaSO4 | 9.1×10-6 |
CaCO3 | 2.8×10-9 |
请回答下列问题:
(1)表1四种酸中,酸性最强的是____________(用化学式表示)。会使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是__________。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)常温下,相同物质的量浓度的表1中4种酸的钠盐pH由大到小的顺序是______________________________ (填钠盐的化学式)。若将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液中各离子浓度由大到小的排列顺序是______________________________。
(3)①根据表2四种难(微)溶物的溶度积常数计算BaSO4的溶解度_______________(单位用g/L)表示,(已知![]() )。
)。
②在含有100mL0.2mol/L Ba2+、Ca2+、Mg2+的混合溶液中加入100mL0.1mol/LNa2SO/span>4溶液,反应后溶液中生成的沉淀是_________,此时SO42-的浓度是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com